셀트리온, 램시마SC 캐나다 허가 신청
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
램시마SC, 유럽 이어 북미지역 첫 허가 신청
42조원 북미 TNF-α 억제제 시장 공략 시동
캐나다 보건청, 바이오베터로 허가 절차 진행
42조원 북미 TNF-α 억제제 시장 공략 시동
캐나다 보건청, 바이오베터로 허가 절차 진행
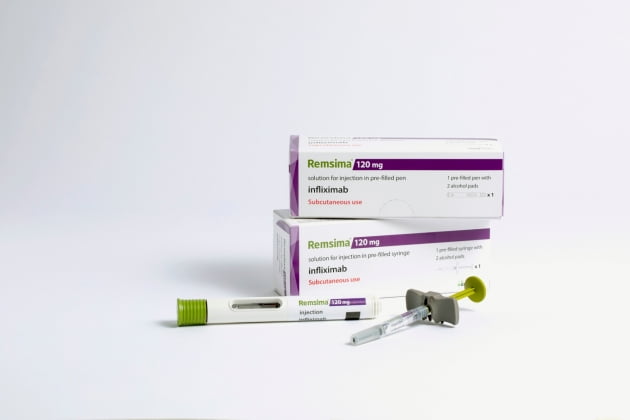
램시마SC는 정맥주사(IV) 제형인 램시마를 피하주사(SC)로 제형을 변경해 자체 개발한 항체 바이오의약품으로 지난해 11월 유럽의약품청(EMA)으로부터 판매 승인을 획득했다.
캐나다 보건청은 EMA에 셀트리온이 제출한 방대한 임상 데이터를 인정해 ‘바이오베터’ 형태로 약 1년 간 허가 심사를 진행할 예정이다. 미국식품의약국(FDA)은 램시마SC를 신약으로 판단해 임상 1·2상을 면제했다. 셀트리온은 지난해 7월부터 임상3상을 진행하고 있다.
미국과 캐나다를 포함한 북미 지역의 자가면역질환 치료제 시장은 42조원 규모로 전 세계 76%에 해당한다.
캐나다에서는 주정부차원에서 의료비 재정 절감을 위해 바이오시밀러 사용을 장려하고 예외적인 경우에만 오리지널 의약품 사용을 허용하는 ‘의무 전환 정책’을 추진하고 있다. 브리티시컬럼비아주에 이어 온타리오주와 앨버타주도 바이오시밀러 전환 정책을 고려 중인 것으로 알려졌다.
셀트리온 관계자는 "캐나다 보건청과 적극 협력해 램시마SC의 허가 절차가 신속히 이뤄져 북미 시장 환자들에게 조기에 선보일 수 있도록 최선을 다하겠다"고 말했다.
전예진 기자 ace@hankyung.com
ADVERTISEMENT
ADVERTISEMENT


![박동현 메지온 회장 "유데나필, 허가신청 작업 순항 중…제품 생산 시작"[인터뷰+]](https://img.hankyung.com/photo/202002/03.21763720.3.jpg)



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


