엑세스바이오, 美 FDA에 독감 진단키트 허가 절차 신청
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
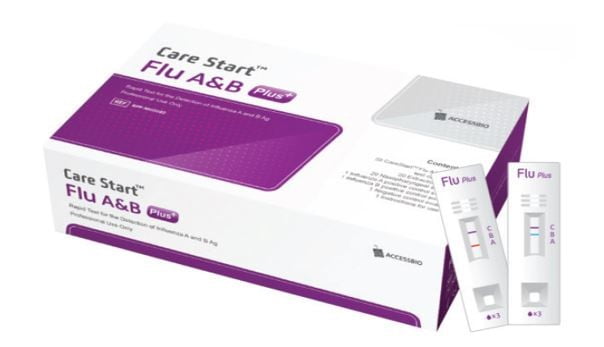
이 제품은 독감 증상을 보이는 환자로부터 검체를 채취해 인플루엔자 A형과 B형을 면역크로마토그래피 방법으로 10분 안에 진단할 수 있다. 면역크로마토그래피는 항원과 항체가 결합하는 원리를 이용하는 것이다.
미국 임상기관 12곳에서 임상을 진행한 결과 이 제품이 FDA에서 요구하는 조건을 충족하는 것을 확인했다. 회사 관계자는 "기온에 따라 결과가 제대로 나오지 않는 사례가 발생하는 등 독감 신속진단키트의 성능을 우려한 FDA가 지난해 관련 기준을 강화했다"며 "새로운 기준에 적합한 임상 결과를 얻었다"고 했다.
세계 독감 시장은 2015년 19억달러에서 2024년 33억달러로 커질 전망이다. 미국은 가장 큰 시장이다.
회사 관계자는 "올해 안에 허가가 완료될 것으로 예상한다"며 "제조업자개발생산(ODM)을 통해 미국 시장에 진출하기 위해 잠재적인 파트너들과 활발하게 논의하고 있다"고 했다. 미국에서 허가를 받은 뒤 유럽, 일본 등 판매 지역을 다변화할 계획이다.
임유 기자 freeu@hankyung.com
ADVERTISEMENT
ADVERTISEMENT



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


