AI 의료기기 개발·허가 동시에
치매·치주질환 진단기기 등은 신의료기술 심사과정 없애
복지부·식약처·심평원이 하던 '이중삼중 심사'도 통합하기로
정부는 ‘포괄적 네거티브 규제혁신’을 의료기기 분야에 처음 도입하기로 했다. 안전성 우려가 작은 의료기기는 ‘선(先) 시장 진입-후(後) 평가’로 의료기기 허가부터 제품 출시까지 걸리는 기간을 대폭 줄여줄 계획이다. 이에 따라 진단기기, 인공지능(AI) 의료기기, 로봇수술기기 등 첨단 의료기기 출시가 늘어날 것으로 전망된다. 또 병원이 자회사를 통해 벤처기업을 설립하는 것을 허용키로 했다. 연구중심병원들의 창업도 크게 늘 것으로 예상된다.
진단기기 업체 A사는 지난 6월 식약처로부터 시판허가를 받은 자가면역질환 진단 키트에 대해 다시 심사받으라는 통보를 받았다. 건강보험심사평가원이 ‘신의료기술평가 대상’으로 분류했기 때문이다. 신의료기술평가 대상으로 분류되면 복지부 신의료기술평가위원회에서 진단 키트로 인한 부작용, 치료효과 등을 다시 심사받아야 한다. 이를 위해 280일 정도 시간이 걸린다. 개발한 의료기기가 환자에게 해를 끼칠 우려가 있는지 등을 확인하는 단계다. 그러나 A사가 개발한 진단 키트는 이런 위험이 전혀 없었다. A사는 심평원에 이의신청을 했다.
이날 정부가 발표한 규제완화 조치에 따라 앞으로 A사 같은 사례는 없어질 것으로 보인다. 신의료기술평가를 받지 않고 제품을 출시할 수 있도록 규제가 완화되기 때문이다. 업계 관계자는 “새로 개발되는 치매, 치주질환 진단 기기 등은 기존 시장에 없던 제품이기 때문에 앞으로 신의료기술평가를 받지 않고 시장에 나올 수 있을 것”이라고 내다봤다.
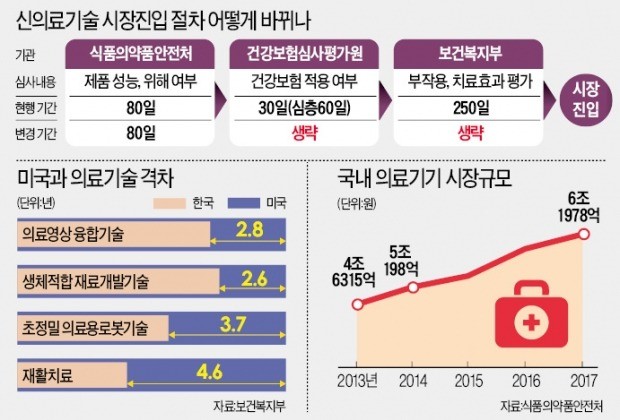
A사가 개발한 체외진단 검사기기처럼 사용자에게 해를 끼칠 우려가 적은 의료기기는 앞으로 시장진입까지 걸리는 기간이 390일에서 80일로 줄어든다.
인공지능 의료기기, 출시 기간 단축
AI 의료기기 출시 기간도 대폭 단축된다. 지난 5월 의료AI 스타트업(신생 벤처기업) 뷰노는 식약처를 통해 골연령판독기 출시 허가를 받았다. AI로 어린이들의 엑스레이를 분석해 성조숙증 위험도 등을 파악하는 기기다. 이를 활용하면 의사가 성조숙증을 진단하는 데 드는 시간을 줄일 수 있다.
하지만 아직 병원에서 제품을 사용할 수 없다. 심평원에서 이 기기가 신의료기기인지 아닌지를 평가하는 데 시간이 걸리기 때문이다. 심평원 평가를 거쳐도 장벽은 남았다. 의료기관에서 이 기기를 사용해도 추가 진료비를 받는 데 어려움이 있다. 제품 개발이력이 짧고 연구결과가 많지 않다 보니 이전에 나온 문헌을 중심으로 평가하는 신의료기술평가에서 제품력을 인정받는 게 어렵기 때문이다.
복지부는 이런 문제도 해결하기로 했다. 의료진의 편의를 높이는 의료기술은 예비분류 코드를 발급해 병원에서 일찍 사용할 수 있도록 했다. 식약처는 혁신·첨단의료기기 개발을 하면서 허가를 함께 받을 수 있는 신속허가 가이드라인도 마련해 지원할 계획이다.
복지부, 식약처, 심평원 제각각 상담도 통합
정부는 소아당뇨 환자 보호자들이 해외 제품을 구매하면서 범법자가 되는 것을 방지하는 장치도 마련했다. 식약처는 7월부터 환자 요청이 있으면 식약처 산하 한국의료기기안전정보원이 직접 의료기기를 수입해 환자에게 공급할 수 있도록 돕기로 했다.
이 같은 정부 방침에 체외진단 기기업계는 환영의 목소리를 냈다. 오기환 한국바이오협회 이사는 “국내 체외진단기업들이 제품의 식약처 허가 이후 신의료평가를 또 거쳐야 하는 이중 규제로 시장진입 지연과 수익성 제한의 어려움을 오랫동안 겪어왔다”며 “이번 규제 혁신을 계기로 다양한 바이오산업 관련 규제가 합리적으로 개선되길 바란다”고 했다.
이지현/임유 기자 bluesky@hankyung.com