바이오치료제 210억弗 시장
일본, 질병종류 제한 삭제…한국은 되레 규제로 '발목'
임상시험, 중국 43건·한국 17건
하지만 2012년 법 개정 이후 상황이 달라졌다. 당시 정부와 코오롱생명과학도 생명윤리법 개정안이 이 같은 문제를 야기할지는 미처 예상하지 못했다. 지난 5월 미국 식품의약국(FDA)의 임상 3상(의약품 허가 마지막 단계) 승인 결정 이후 8만원대이던 주가가 21만원까지 급등하는 등 관심을 모으고 있는 코오롱생명과학의 신약개발이 국내에서 뜻하지 않은 ‘규제 암초’를 만난 것이다.
◆거꾸로 가는 신약개발 규제
2012년 당시 정부는 유전자 치료제에 대한 안전성 문제가 부각되자 유전자 치료제 허가 기준을 강화했다. 연구 질환 대상을 ‘유전질환, 암, 후천성면역결핍증 그 밖에 생명을 위협하거나 심각한 장애를 일으키는 질병’으로 제한했다. 그러면서 ‘현재 이용 가능한 치료법이 없거나 유전자 치료의 효과가 다른 치료와 비교했을 때 현저히 우수할 것으로 예측되는 경우’란 조건도 함께 충족해야 신약허가를 내주도록 했다. 퇴행성관절염 치료제는 생명과 직접 관련된 질병으로 보기 어렵다는 게 업계의 중론이다. 두 가지 조건 중 이미 한 기준에 미달하는 셈이다.
그러면서 ‘개정 이전 개발에 착수한 의약품에 소급적용하지 않는다’는 기준을 따로 명시하지 않아 혼란을 예고했다. 코오롱생명과학 관계자는 “허가는 정부의 권한으로 함부로 얘기할 수 없다”면서도 “회사 내부적으로 굉장히 우려하고 있는 것은 사실”이라고 말했다.
지난해 12월 문정림 새누리당 국회의원(비례대표)이 이 같은 문제를 해소하기 위해 생명윤리법 개정안을 발의했지만 논의조차 안되고 있다. 문 의원은 두 가지 중 하나의 조건만 충족하면 유전자 치료제 연구를 할 수 있도록 완화했다.
◆치료제 개발 ‘美 1357건, 韓 17건’
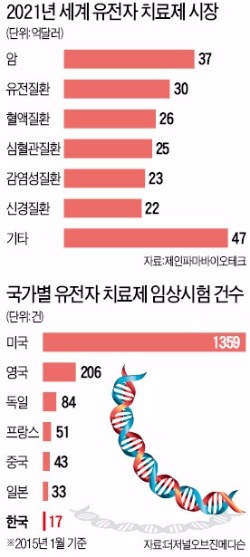
국내에서는 바이로메드, 제넥신 등 바이오기업들이 유전자 치료제 개발에 뛰어들었지만 세계적 수준에 한참 뒤처져 있다. 유전자 치료제 개발을 위한 임상시험은 세계에서 2142건(올 1월 기준) 이뤄지고 있다. 한국은 17건에 불과하다. 미국(1359건) 영국(206건) 독일(84건) 프랑스(51건) 등 선진국에 비해 크게 적다. 중국(43건)에도 못 미친다.
업계에서는 연구할 수 있는 질병에 제한을 둔 규정부터 풀어야 한다고 요구하고 있다. 선진국에서는 심혈관 질환, 감염성 질환, 파킨슨 질환, 안질환 등 다양한 질병에 대한 유전자 치료제 연구를 허용하고 있다. 일본도 올해 ‘유전자 치료 임상 연구에 관한 지침’에서 치료 대상 질환을 명시한 조항을 삭제했다.
■ 유전자 치료제
gene medicine. 잘못된 유전자를 정상 유전자로 바꾸거나 치료 효과가 있는 유전자를 재료로 하는 치료제.
조미현 기자 mwise@hankyung.com


!["中 흑자 파티, 한국은 사업 접을 판"…생각보다 심각한 상황 [성상훈의 배터리스토리]](https://img.hankyung.com/photo/202412/01.38934975.3.jpg)






![[단독] 與, '한동훈 사살설' 김어준에 법적대응 나선다](https://img.hankyung.com/photo/202412/ZN.38932878.3.jpg)