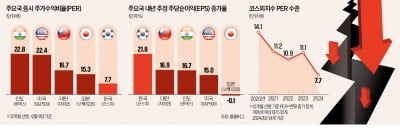
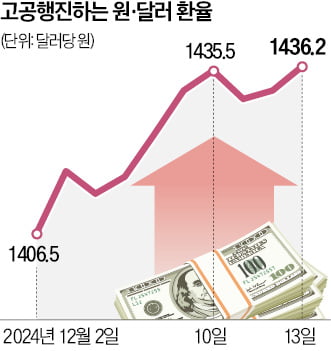
녹십자셀, 진행성 간암치료제 연구자 임상시험 승인
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
녹십자셀(대표: 한상흥)은 면역세포치료제 ‘이뮨셀-LC’의 진행성 간암에 대한 연구자 주도 2상 임상시험 계획을 식품의약품안전처(식약처)로부터 승인 받았다고 26일 밝혔다.
‘이뮨셀-LC’는 환자 자신의 혈액에서 면역세포를 추출, 약 2주의 특수한 배양과정을 통해 항암 활성이 증강된 림프구로 다량 증식시킨 후 환자에게 주사제로 투여하는 환자 맞춤형 항암면역세포치료제다.
식약처 승인에 따라 가톨릭대 서울성모병원, 고려대안암병원, 연세대 세브란스병원, 인하대병원에서 진행될 연구자 주도 2상 임상시험은 진행성 간암, 즉 3~4기의 넥사바 치료 간암환자를 대상으로 ‘이뮨셀-LC’를 치료 할 때 유효성을 확인하기 위한 임상시험이다. 현재 말기 간암의 항암제로 유일한 넥사바는 생존기간을 2.8개월 연장하는 것으로 알려져 있다.
최종성 녹십자셀 CTO는 "이미 간암 3상 임상시험에서 1~2기 간암환자에 대한 이뮨셀-LC의 효과를 확인한 만큼 이번 진행성 간암에 대한 연구자 주도 2상 임상시험도 좋은 결과가 기대된다"며 "넥사바와 병용치료를 통해 더 많은 환자들의 희망이 될 것으로 기대한다"고 말했다.
녹십자셀은 ‘이뮨셀-LC’의 간암 3상 임상시험을 2008년부터 230명의 간암환자를 대상으로 진행해 성공리에 마치고, 추적관찰 기간을 3년 더 연장하는(총 5년 추적관찰) '장기추적관찰 임상시험'도 함께 진행 중이다. 임상연구자들은 저명학술지를 통해 간암 3상 임상시험 결과를 논문으로 발표하기 위해 준비하고 있다.
한경닷컴 정형석 기자 chs8790@hankyung.com
‘이뮨셀-LC’는 환자 자신의 혈액에서 면역세포를 추출, 약 2주의 특수한 배양과정을 통해 항암 활성이 증강된 림프구로 다량 증식시킨 후 환자에게 주사제로 투여하는 환자 맞춤형 항암면역세포치료제다.
식약처 승인에 따라 가톨릭대 서울성모병원, 고려대안암병원, 연세대 세브란스병원, 인하대병원에서 진행될 연구자 주도 2상 임상시험은 진행성 간암, 즉 3~4기의 넥사바 치료 간암환자를 대상으로 ‘이뮨셀-LC’를 치료 할 때 유효성을 확인하기 위한 임상시험이다. 현재 말기 간암의 항암제로 유일한 넥사바는 생존기간을 2.8개월 연장하는 것으로 알려져 있다.
최종성 녹십자셀 CTO는 "이미 간암 3상 임상시험에서 1~2기 간암환자에 대한 이뮨셀-LC의 효과를 확인한 만큼 이번 진행성 간암에 대한 연구자 주도 2상 임상시험도 좋은 결과가 기대된다"며 "넥사바와 병용치료를 통해 더 많은 환자들의 희망이 될 것으로 기대한다"고 말했다.
녹십자셀은 ‘이뮨셀-LC’의 간암 3상 임상시험을 2008년부터 230명의 간암환자를 대상으로 진행해 성공리에 마치고, 추적관찰 기간을 3년 더 연장하는(총 5년 추적관찰) '장기추적관찰 임상시험'도 함께 진행 중이다. 임상연구자들은 저명학술지를 통해 간암 3상 임상시험 결과를 논문으로 발표하기 위해 준비하고 있다.
한경닷컴 정형석 기자 chs8790@hankyung.com