일본 오사카대 연구진, 저널 '캔서 리서치'에 논문
일종의 '전사 조절' 단백질인 p53은 DNA 손상과 같은 세포 스트레스 요인에 반응해 활성화한다.
p53이 활성화하면 세포 예정사 프로그램 등 다양한 생리 과정이 뒤따라, DNA 손상 등이 생긴 비정상 세포가 암으로 변하는 게 억제된다.
p53에 '유전체의 수호자'(guardian of the genome)라는 별칭이 붙은 이유가 여기에 있다.
간세포 암종(hepatocellular carcinoma) 등 여러 유형의 암에서 p53의 돌연변이가 흔히 발견되는 것도 같은 맥락으로 이해된다.
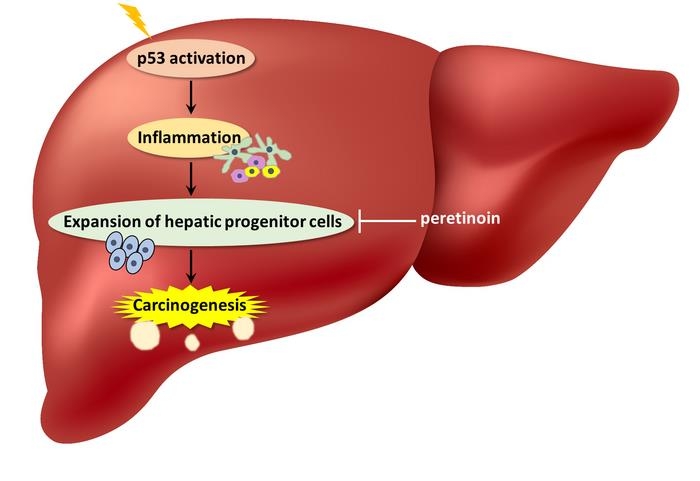
그런데 만성 간 질환(CLD) 환자의 간세포에 p53이 지속해서 활성화하면 간암의 발생을 촉진할 수 있다는 연구 결과가 나왔다.
유독 만성 간 질환에 대해선 p53이 알려진 것과 정반대로 작용한다는 의미다.
일본 오사카대 과학자들이 수행한 이 연구 결과는 12일(현지 시각) 미국 암 연구 협회 저널 '캔서 리서치'(Cancer Research)에 논문으로 실렸다.
1941년 창간된 이 저널은 암과 관련 생물 의학 연구를 다루는 '동료 심사'(peer review) 의학 학술지다.
하지만 어떤 요인이 작용하든 상관없이 p53은 활성화될 수 있다.
만성 간 질환 환자의 간세포에서 p53이 변함없이 활성 상태를 유지한다는 건 임상 데이터로 확립된 사실이다.
불확실한 부분은 만성 간 질환의 병리 생리학적 측면에서 p53이 어떤 역할을 하느냐였다.
인체가 종양 발생을 막는 메커니즘에서 p53이 핵심 역할을 한다는 걸 고려하면 이번 연구 결과는 더 이해하기 힘든 현상이다.
오사카대 의과대학원의 마케하라 테쓰오 위장병학 간장학 교수팀은 간세포에 p53이 많이 발현하게 조작한 생쥐 모델에 실험했다.
p53의 수위를 조절하는 Mdm2 단백질이 아예 생기지 않게 이 단백질의 생합성 암호를 가진 같은 이름의 유전자를 제거했다.
Mdm2 단백질은 p53에 '분해 대상' 꼬리표를 붙이는 방법으로 발현 도를 제어한다.
이런 생쥐는 간세포의 자멸사(apoptosis)와 '노화 관련 분비성 표현형'(SASP)이 동시에 증가하면서 간에 염증이 생겼다.
이런 현상이 나타날 때 세포는, 다른 세포가 암세포로 변하게 유도하는 신호를 주변 미세환경에 내보낸다.
실제로 간세포에 p53가 축적된 생쥐 모델은 더 높은 빈도로 간 종양이 발생했다.
아울러 줄기세포와 비슷한 특성이 있는 '간 전구세포'(HPCs)의 급격한 증가도 관찰됐다.
이 HPCs를 분리해 실험실에서 배양한 뒤 다른 생쥐의 피하에 주입하면 역시 종양이 생겼다.
간세포에 p53이 많은 생쥐의 간 종양 형성에 간 전구세포가 매우 중요한 역할을 한다는 걸 시사한다.
흥미롭게도 Mdm2 유전자에 더해 p53 유전자까지 제거하면 간 종양의 발달이 빨라지지도, 노화 관련 분비성 표현형이 증가하지도 않았다.
p53이 지속해서 발현하는 게 간 종양의 형성에 중요하다는 걸 보여주는 대목이다.

본질적으로 만성 간 질환 환자의 간세포에서 p53이 활성화하면 간 전구세포로부터 종양이 생기기 쉬운 미세환경이 조성된다는 게 연구팀의 결론이다.
종양 억제 유전자로서 p53의 명성을 생각하면 하나의 역설적인 간 종양 형성 메커니즘이 제시된 셈이다.
물론 만성 간 질환 환자에겐 p53이 잠정적인 항암 치료 표적이 될 수 있다는 뜻이기도 하다.
/연합뉴스








