화이자에 밀린 K시밀러 '신제품 속도전'
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
K바이오 대해부
(9) 삼성·셀트리온의 승부수
FDA 허가 바이오시밀러
화이자 8개로 가장 많아
2위로 밀린 삼성·셀트리온
품질 높이고 제형 바꿔 공략
(9) 삼성·셀트리온의 승부수
FDA 허가 바이오시밀러
화이자 8개로 가장 많아
2위로 밀린 삼성·셀트리온
품질 높이고 제형 바꿔 공략

화이자 8개, 삼성·셀트리온 5개
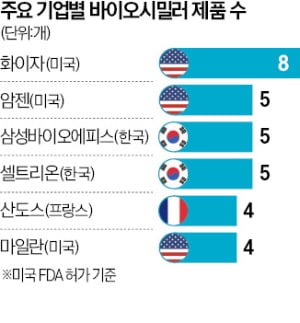
그 뒤를 삼성바이오에피스, 셀트리온 등 국내 기업이 바짝 쫓고 있다. 허셉틴, 휴미라를 포함해 각각 5개씩 FDA 승인을 받았다. 암젠도 같은 수의 제품을 허가받으며 2위에 이름을 올렸다. 이어 프랑스 산도스와 미국 마일란이 4개, 암닐과 코헤러스가 3개로 뒤따르고 있다.
2019년까지만 해도 ‘바이오시밀러=한국’으로 통했다. 2016년 존슨앤드존슨의 블록버스터 류머티즘 관절염 치료제 ‘레미케이드’ 바이오시밀러의 FDA 허가를 가장 먼저 받아낸 건 셀트리온이었다. 2등은 삼성바이오에피스(2017년)였다. 하지만 화이자, 암젠 등 자금력과 영업력을 앞세운 글로벌 제약사들이 뛰어들면서 상황이 달라졌다.
2017년 FDA의 품목 허가를 처음 받은 화이자는 2018년 2개, 2019년 4개의 바이오시밀러 제품을 잇달아 내놓았다. 암젠은 휴미라 바이오시밀러를 셀트리온과 삼성바이오에피스보다 6개월 빠른 지난 1월 출시했다. 일라이릴리, 베링거인겔하임 등도 뛰어들었다.
농도·제형 바꾸고 속도전으로 ‘승부’
한국 기업들은 농도 및 제형 변화에 차별점을 둔 제품과 특유의 속도전에서 지닌 강점을 바탕으로 다시금 글로벌 강자로 올라서겠다는 전략을 펴고 있다. 우선 세계 매출 1위 휴미라 바이오시밀러의 경우 ‘고농도’ 제품으로 승부를 걸고 있다.고농도 제품은 저농도에 비해 투여 용량이 적은 장점 덕분에 미국 처방 건수의 80%가량을 차지하고 있다. 이 때문에 암젠도 지난 1월 저농도 제형을 우선 허가받아 출시한 후 다시 고농도 제형 임상을 진행 중이다. 제형 변화도 꾀한다. 셀트리온은 주사제인 휴미라를 세계 최초로 경구용으로 개발 중이다.
제품 수도 늘린다. 삼성바이오에피스는 기존 시판한 제품 외에 아일리아(안과질환), 프롤리아(골다공증), 스텔라라(자가면역질환) 등 3종의 바이오시밀러에 대한 임상 3상을 완료하고 연내 허가신청에 나설 계획이다. 셀트리온은 6개인 바이오시밀러 제품군을 2025년까지 11개로 확대할 예정이다.
다만 허가, 출시 다음 단계인 ‘판매’를 위해 미국 보험시장 관문을 넘는 것은 또 다른 변수로 꼽힌다. 바이오업계 관계자는 “7월 휴미라 바이오시밀러 출시 이후 판매를 위해 셀트리온과 삼성바이오에피스 모두 보험사 2~3곳과 논의를 이어가고 있지만 계약까지는 어려움을 겪을 것”이라며 “화이자 등 글로벌 대형 제약사들의 영업력을 어떻게 넘어설지가 관건”이라고 말했다.
남정민 기자 peux@hankyung.com
ADVERTISEMENT
ADVERTISEMENT





![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


