알츠하이머병 일으키는 타우 단백질의 '양성 피드백' 발견
소교세포의 변형 타우 포식 둔화→뉴런 손상 확산
미국 웨일 코넬 의대 연구진, 저널 '네이처 커뮤니케이션' 논문
인간의 신경계는 크게 중추신경계와 말초신경계로 나눌 수 있다.
각각의 신경계는 뉴런(신경세포)과 교세포로 구성된다.
하지만 뉴런은 약 10%에 불과하고 나머지 90%는 신경계를 지지하는 교세포(neuro-glia)다.
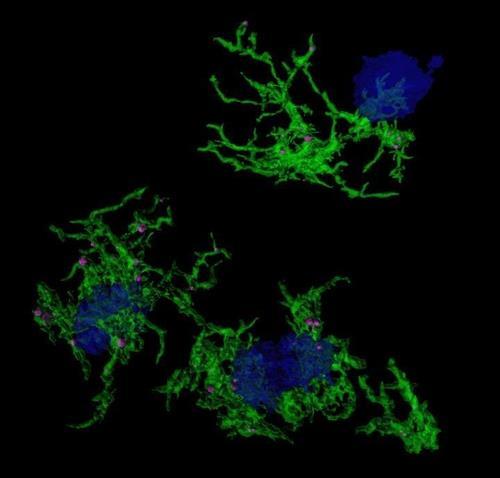
중추신경계 교세포 가운데 면역 기능을 수행하는 게 바로 소교세포(microglia)다.
소교세포는 대식세포처럼 신경계의 노폐물 등을 먹어 치운다.
신경 퇴행 질환 환자에게는 공통으로 소교세포의 활성화로 인한 염증이 나타난다.
이런 염증을 진정시키면 알츠하이머병 등 주요 신경 퇴행 질환의 진행을 늦출 수 있을 거로 과학자들은 믿는다.
그런데 소교세포의 과잉 활성화와 염증 자극에 변형 타우 단백질이 관여한다는 연구 결과가 나왔다.
타우 단백질은 NF-kB라는 다기능 신호 경로를 통해 염증성 소교세포의 활성화를 자극하는 것으로 밝혀졌다.
알츠하이머병이 생긴 생쥐 모델 실험에서 이 신호 경로가 유력한 치료 표적이라는 게 확인됐다.
이 신호 경로를 억제하면 소교세포가 염증을 촉진하는 상태에서 벗어나고, 손상된 학습 및 기억 기능도 복원됐다.
타우 단백질이 실처럼 가늘게 변해 뒤엉긴 '타우 탱글'(tau tangles)이 뇌 조직에 침적하는 것도 알츠하이머병의 주요 특징 가운데 하나다.
미국의 웨일 코넬 의대 과학자들이 수행한 이 연구 결과는 12일(현지 시각) 저널 '네이처 커뮤니케이션'(Nature Communications)에 논문으로 실렸다.
알츠하이머병 외에도 파킨슨병, 피크병(Pick diseaseㆍ치매의 일종), 진행성 핵상 마비(progressive supranuclear palsy), 전측두엽 치매(frontotemporal dementia) 등에서 모두 그렇다.
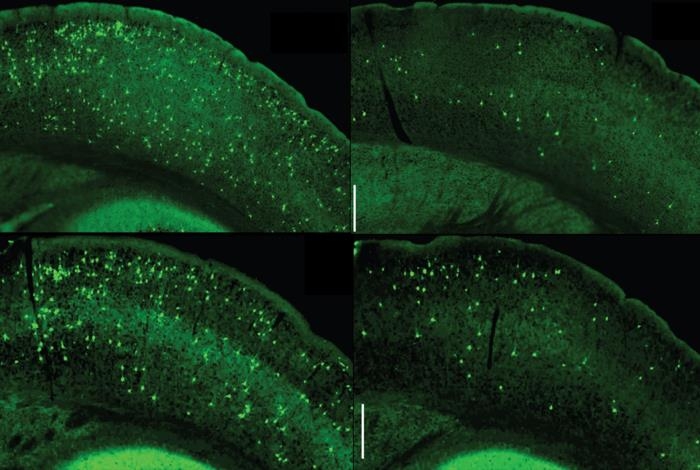
실험동물의 뇌에 타우 탱글을 주입하면 마치 씨를 뿌린 것처럼 연쇄반응이 일어나 새로 생긴 타우 탱글이 뇌의 다른 영역으로 확산한다.
알츠하이머병이나 타우 병증(tauopathy) 환자의 뇌 조직을 검시해 보면, 타우 탱글의 확산이 질병의 진행과 밀접히 연관돼 있다는 게 드러난다.
논문의 수석저자인 간리(Li Gan) 신경학 교수는 "NF-κB 신호 경로의 과잉 활성화를 억제하는 게 알츠하이머병과 다른 타우 매개(tau-mediated) 신경 퇴행 질환을 치료하는 좋은 표적이 될 수 있다"라고 말했다.
하지만 변형 타우 단백질이 정확히 어떻게 작용해 뇌의 뉴런이 손상되는지는 이번 연구 전까지 잘 알지 못했다.
간 교수팀은 선행 연구에서 타우 탱글이 소교세포를 염증 촉진 상태로 몰아넣을 수 있다는 걸 발견했다.
이렇게 성질이 변한 소교세포는 평소처럼 효율적으로 타우 탱글을 포식하지 못했고, 심지어 삼켰던 것을 다시 토해내기도 했다.
그렇게 되면 많은 타우 탱글이 새로운 변형 단백질의 씨를 뿌리는 형태로 남아 결국 타우 탱글의 확산으로 이어졌다.
간 교수팀은 이번 연구에서 소교세포가 염증을 촉진하고 신경 퇴행 질환을 일으키는 상태로 전환하는 메커니즘을 발견했다.
이 과정을 주도하는 게 바로 타우 탱글이었다.
타우 탱글은 소교세포의 NF-κB 신호 경로를 자극해 소교세포를 이런 상태로 몰아넣었다.
타우 탱글이 뿌린 씨로 인해 뇌에 타우 탱글이 널리 퍼진 알츠하이머병 생쥐 모델에 실험해 보니 이 과정엔 일종의 '양성 피드백'(positive feedback)이 작동했다.
다시 말해, 소교세포의 NF-κB 경로를 과잉 활성 상태로 유지하면 타우 탱글의 파종(播種)과 확산을 부추겨 NF-κB 경로가 더 활성화됐다.
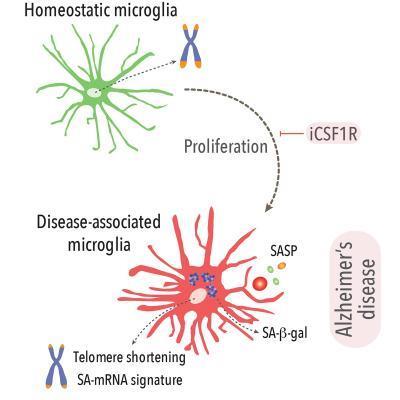
그러나 NF-κB 경로를 차단하기만 하면 곧바로 악순환의 고리가 끊겨 타우 탱글의 확산이 눈에 띄게 줄었다.
연구팀은 뇌의 뉴런에 타우 탱글이 침적된 생쥐 모델에서 소교세포의 NF-κB 경로를 비활성으로 전환해 봤다.
그러자 소교세포의 염증 촉진성이 거의 전부 사라지고 겉모습과 유전자 활성 패턴이 정상인 소교세포가 확연히 늘어났다.
아울러 소교세포가 독성 타우의 씨앗을 토해내는 것이 감소하고, 생쥐의 인지 및 기억 결함이 진행하는 것도 억제됐다.
연구팀이 내린 결론은, 타우 탱글이 내는 독성 효과로 인지 기능이 손상되려면 소교세포의 NF-κB 경로가 관여해야 한다는 것이다.
지난 20여 년간 나온 알츠하이머병 실험 치료제는 대규모 임상 실험에서 모두 실패했다.
이들 치료제는 대부분 베타 아밀로이드 단백질을 표적으로 질병의 진행을 늦추거나 멈추게 하는 것이었다.
그러다가 최근 들어서 타우 단백질을 표적으로 하는 연구도 조금씩 늘고 있다.
간 교수는 "이번 연구를 통해 과잉 활성화된 소교세포의 NF-κB 신호 경로를 안정시키는 약이 더 좋은 효과를 낼 수 있다는 걸 알게 됐다"라고 강조했다.
알츠하이머병 연구의 무게 중심이 종전의 베타 아밀로이드에서 타우로 넘어갈지 주목된다.
/연합뉴스
-
기사 스크랩
-
공유
-
프린트













![[오늘의 arte] 독자 리뷰 : 당신의 미술 취향은 무엇인가요](https://timg.hankyung.com/t/560x0/photo/202404/AA.36523699.3.jpg)