국산 코로나 백신 나오나…식약처, 임상 1상·치료제 2상 승인

국내 코로나19 관련 임상시험 승인은 30건이다. 이 가운데 22건(치료제 19건, 백신 3건)이 진행 중이다.
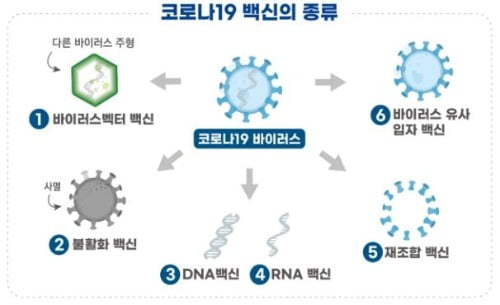
SK바이오사이언스의 NBP2001 임상 1상은 성인을 대상으로 안전성과 면역원성을 평가한다. 백신은 코로나19 바이러스의 표면항원 단백질을 유전자조합기술로 제조한 '재조합 백신'이다.
단백질이 면역세포를 자극해 면역 반응을 유도한다. 바이러스가 침입하 항체가 바이러스를 제거한다.
임상시험을 승인한 2건의 백신은 'DNA 백신'이다. 코로나19 바이러스의 표면항원 단백질 유전자를 주입해 면역반응을 유도한다.
동화약품의 'DW2008S' 임상 2상은 중등증 코로나19 환자를 대상으로 유효성과 안전성을 평가하고 있다.
윤진우 기자 jiinwoo@hankyung.com
기사제보 및 보도자료 newsinfo@hankyung.com
-
기사 스크랩
-
공유
-
프린트












![르세라핌, 美서 라이브 '대참사'…'K팝 아이돌' 논란 터졌다 [이슈+]](https://timg.hankyung.com/t/560x0/photo/202404/01.36438208.3.jpg)