줄기세포 치료도 의료기기 개발도…정부 위원회 '몽니'에 좌절
멀고 먼 헬스케어 규제개혁
심근세포 살려주는 '매직셀'
2014년 연구방법 논의 끝냈는데
신의료기술평가委 이제와 '퇴짜'
김효수 서울대병원 순환기내과 교수의 하소연이다. 김 교수는 국내 줄기세포 연구 1세대로 꼽힌다. 서울대병원 선도형 세포치료 연구사업단장을 맡고 있다. 그동안 사업단이 받은 연구비는 500억원에 이른다. 국제학술지에 실린 논문만 16편이다. 급성 심근경색 줄기세포 치료법인 매직셀은 김 교수팀의 첫 결과물이다. 하지만 한국보건의료연구원 신의료기술평가위원회는 이 기술의 시장 진입을 허용하지 않았다. 관련 논문과 연구서만 24편을 제출했지만 근거가 부족하다고 했다. 해외에서도 인정하는 혁신기술이 ‘위원회 몽니’에 좌절하게 됐다는 비판이 나오는 이유다.
심근경색 줄기세포 치료법 ‘사장 위기’
급성 심근경색은 심장 근육에 혈액을 공급하는 혈관이 혈전으로 막히는 질환이다. 국내 돌연사의 80%는 급성 심근경색 때문에 발생하는 것으로 알려졌다. 환자가 병원을 찾아 약을 먹거나 스탠트(막힌 곳을 뚫는 가는 철망) 시술을 받아도 30% 정도는 심장이 제 기능을 못하는 심부전 상태가 된다. 심근세포가 서서히 죽기 때문이다. 급성 심근경색 환자 사망률이 높은 원인이다.
매직셀은 심근세포를 살려주는 줄기세포 치료다. 심근경색 진단을 받은 뒤 한 달 안에 이 치료를 받으면 심부전이 생길 위험이 10% 정도로 떨어진다. 환자의 3분의 2 정도가 돌연사 등의 위험으로부터 벗어날 수 있다는 의미다.
김 교수팀은 2003년 줄기세포가 혈관벽 재생을 돕는다는 내용의 동물실험 결과를 국제학술지에 공개했다. 말초혈액에서 뽑은 줄기세포를 심근경색 치료에 사용할 수 있다는 연구 결과는 2004년 국제학술지 란셋에 발표했다. 세계 첫 연구 결과다. 란셋은 의사라면 누구나 한 번쯤 논문을 발표하고 싶어 하는 의료계 최고 권위의 국제학술지다.
말 바꾼 신의료기술평가위원회
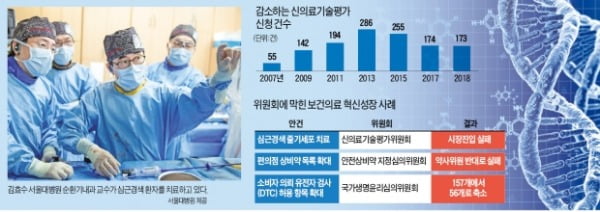
김 교수는 임상논문만 17편을 발표했지만 정작 환자 치료에는 쓸 수 없었다. 국내에서는 새로운 의료기술을 환자 치료에 쓰고 치료비를 받으려면 보건의료연구원의 신의료기술평가를 통과해야 하기 때문이다.
2014년 김 교수팀은 보건의료연구원의 문을 두드렸다. 이곳에서 환자 70명의 치료 데이터를 모아 안전성과 유효성을 입증하면 임상 현장에서 쓸 수 있도록 허용하겠다는 약속을 받았다. 김 교수는 “50명 정도 환자 등록이 된 시점에 보건의료연구원이 기술평가건을 마무리 짓자고 요구해 환자 40명의 치료 결과를 제출했다”고 했다.
김 교수팀은 2017년 환자 데이터를 제출한 뒤 임상 연구를 중단했다. 매직셀 치료를 한 환자를 평가한 대부분 지표는 좋은 것으로 나타났다. 하지만 기술평가는 차일피일 미뤄졌다. 지난해 말 신의료기술평가위원회가 구성돼 결과를 내놓을 때까지 2년간 서울대병원에서만 50여 명의 환자가 치료를 받지 못했다. 환자들은 “새 줄기세포 치료를 허용해달라”며 복지부 등에 탄원서까지 보냈다. 하지만 신의료기술평가위원회의 최종 결정은 ‘사용불가’였다. 연구 설계에 문제가 있다는 게 이유였다.
신의료기술평가위원회는 “효능을 평가하려면 스탠트 시술과 매직셀 치료를 함께한 환자와 스탠트 시술만 한 환자 데이터를 비교해야 하는데 그렇지 않았다”고 했다. 매직셀 치료 환자 데이터만 보겠다던 2014년 약속을 신의료기술평가위원회가 뒤집었다는 게 김 교수의 주장이다. 김 교수는 “2014년 위원회의 결정 내용을 토대로 연구를 설계했는데 이제 와서 다른 말을 한다”며 “비교연구는 이미 이전에 진행한 여러 논문을 통해 충분히 입증했다”고 했다. 그는 “균형감각, 현실감각, 미래지향적 융통성이 떨어지는 평가위원들이 불필요한 갈등을 야기하고 있다”고 토로했다.
신의료기술평가위원회 문턱에 막힌 것은 김 교수의 연구뿐만이 아니다. 국산 의료기기를 개발하고 신의료기술평가를 통과해야 돈을 받을 수 있는 기업들은 대부분 같은 경험을 한다. 그나마 병원에서 연구 결과물을 낼 수 있는 교수들은 낫다는 평가다.
업계 관계자는 “일반 의료기기 회사들은 연구 데이터를 쌓을 만한 곳을 찾는 단계부터 어려움이 시작된다”며 “새 기술을 개발해 근거를 만들고 논문을 낸 뒤 결과 평가를 받는 과정을 거치면 이미 헌 기술이 된다”고 했다. 국내 헬스케어 기업들이 국내 시장을 포기하고 해외로 눈을 돌리는 배경이다.
신의료기술평가뿐만이 아니다. 정부가 스스로 결정하기 부담스러운 사안을 전문가 등으로 구성된 각종 위원회에 맡기다 보니 기술 도입까지 불필요한 시간이 걸린다는 지적도 나온다. 의사, 약사 등으로 구성된 위원회가 이익단체의 목소리를 대신하는 일도 비일비재하다.
소비자 의뢰 유전자검사(DTC) 항목을 확대하려던 정부 계획은 국가생명윤리심의위원회에 막혀 1년 넘게 미뤄졌다. 이마저도 당초 150여 개를 확대하려던 계획이 56개로 축소됐다. 위원들의 반대 때문이었다. 복지부는 이를 다시 확대하겠다는 규제개혁안을 내놨지만 반대하는 위원들을 설득할 수 있을지는 미지수다.
24시간 문 여는 편의점에서 판매하는 가정용 상비약 개수를 확대하려던 정부 계획도 마찬가지다. 2018년 안전상비약지정심의위원회에서 약사 위원이 반대해 무산된 뒤 추가 회의 일정조차 잡지 못하고 있다.
이지현 기자 bluesky@hankyung.com
-
기사 스크랩
-
공유
-
프린트











