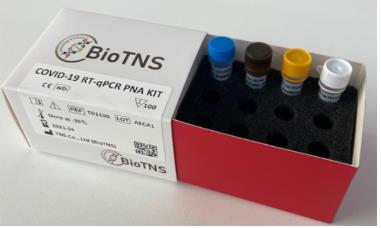
티엔에스, 코로나19 분자진단키트 미국 FDA 긴급사용 승인 획득
이 제품은 실시간 유전자 증폭(RT-PCR) 방식으로 국내 식품의약품안전처로부터 지난달 수출용 허가를 받았다.
나노종기원은 이 진단키트는 다른 진단키트보다 민감성 및 정밀성이 2~5배 높고 위음성과 위양성이 낮으며, 높은 수율을 확보할 수 있는 공정기술 등으로 가격 및 기술경쟁력을 높였다고 설명했다.
김봉석 티엔에스 대표는 "나노종기원과의 협업으로 60카피 유전자의 증폭(통상 100~1,000카피 필요)만으로도 코로나19를 진단할 수 있는 진단시약 기술력을 조기에 확보하고 제품을 양산할 수 있게 됐다"며 "국내·외 체외진단시장을 적극적으로 공략할 계획"이라고 밝혔다.
-
기사 스크랩
-
공유
-
프린트

![[단독] 백악관·NASA 출신 존 리 교수…초대 우주항공청 본부장에 내정](https://img.hankyung.com/photo/202404/AA.36505609.3.jpg)










!['베니스의 장인들' 르네상스 조선소에 쿵쿵쿵 망치질! 클래스가 달랐던 토즈 전시 [2024 베네치아 비엔날레]](https://timg.hankyung.com/t/560x0/photo/202404/01.36496137.3.jpg)