미국 FDA 긴급사용승인 국산 진단키트 8개사 제품으로 늘어(종합)
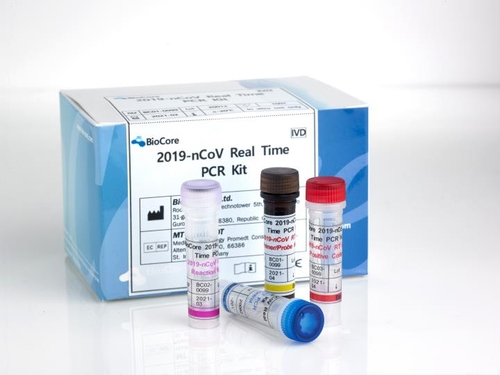
분자진단 기업 바이오코아는 미국 FDA로부터 신종 코로나바이러스 감염증(코로나19) 진단키트의 EUA를 획득했다고 22일 밝혔다.
이 제품은 실시간 유전자 증폭(RT-PCR) 방식으로 코로나19 감염 여부를 확인하는 진단키트다.
바이오코아는 현재 국내는 물론 독일, 이탈리아, 스페인, 인도, 사우디, 가나 등 전 세계 20여 개국에 수출을 진행하고 있다.
미국 FDA 긴급사용승인을 계기로 미국 수출이 늘어날 것으로 기대하고 있다.
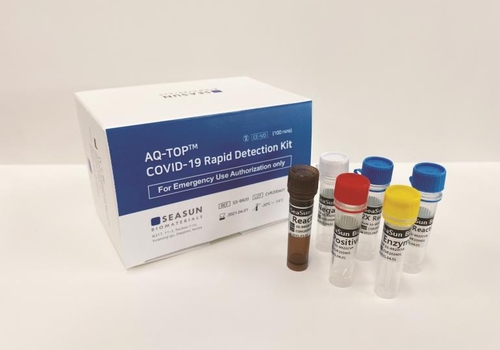
같은 날 시선바이오머티리얼스가 15분 이내에 코로나19 감염 여부를 확인할 수 있는 신속 진단키트 '아큐탑 코비드19 래피드 디텍션 키트'의 미국 FDA EUA를 받았다고 밝혔다.
시선바이오머티리얼스는 지난달 27일 미국 FDA에서 '유탑 코비드19 디텍션 키트'의 EUA를 받은 데 이어 두 번째 EUA를 획득했다.
국내에서 유일하게 미국 FDA로부터 코로나19 진단키트 제품으로 2개 품목을 EUA를 획득한 기업이 됐다.
박희경 시선바이오머티리얼스 대표는 "이번 제품은 공항, 검역소 등 신속진단 및 응급 선별검사가 필요한 현장, 재감염 추적관리를 위해 높은 민감도와 특이도가 요구되는 상황 등에서 요긴하게 쓰일 수 있을 것"이라며 "전 세계적으로 빠르게 확산하고 있는 코로나19 방역에 많은 도움이 될 것"이라고 기대했다.
미국에서 EUA를 획득한 국산 진단키트 업체는 오상헬스케어, 씨젠, SD바이오센서, 시선바이오머티리얼스, 랩지노믹스, 원드롭(1 drop) 진매트릭스, 바이오코아 등 8개사다.
시선바이오머티리얼스가 2개 품목을 허가받아 제품 수 기준으로는 9개가 된다.
이 중 씨젠, SD바이오센서, 바이오코아 등 3개사는 국내 식품의약품안전처의 긴급사용승인과 수출용 허가, 미국 FDA의 EUA를 모두 획득했다.
-
기사 스크랩
-
공유
-
프린트












![[오늘의 arte] 예술인 QUIZ : 단편 '일러두기'로 이상문학상 수상](https://timg.hankyung.com/t/560x0/photo/202404/AA.36512057.3.jpg)