동아에스티, 글로벌 신약 개발 '가속도'
유럽선 빈혈 치료제 임상 3상
강수형 사장 "기술 수출 기대"

동아에스티(사장 강수형·사진)는 미국 제약업체 토비라가 미국에서 비알코올성 지방간염(NASH) 치료 복합제에 대한 임상 1상 시험을 시작했다고 12일 발표했다. 토비라는 지난달 미국 식품의약국(FDA)에서 임상 1상 승인을 받았고 지난주 첫 투약을 했다.
동아에스티는 지난 4월 토비라와 700억원 규모의 당뇨병 치료제 에보클립틴 기술 이전 계약을 맺었다. 토비라는 자체 개발 중인 NASH 치료제 세니크리비록에 에보클립틴 물질을 넣은 복합제로 치료 효과를 높이는 연구를 하고 있다. 동아에스티는 시벡스트로에 이은 두 번째 글로벌 신약이 될 것으로 기대하고 있다.
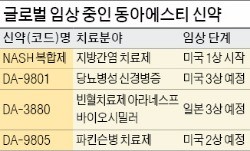
빈혈 치료제 바이오시밀러(항체의약품 복제약)는 유럽과 일본에서 임상 3상을 앞두고 있다. 오리지널 의약품인 암젠의 아라네스프 매출은 30억달러 규모다. 파킨슨병 치료제(DA-9805)는 미국 임상 2상, 과민성 방광 치료제(DA-8010)는 유럽 임상 1상을 준비 중이다. 전임상단계인 류머티즘 바이오시밀러 스테렐라는 글로벌 제약사들의 러브콜을 받고 있다.
강수형 동아에스티 사장은 “희귀병 치료제 개발에도 나서는 등 신약 파이프라인(후보물질)을 공격적으로 확대해나갈 계획”이라고 말했다.
동아에스티는 슈가논 시벡스트로 등 신약의 해외 시장 개척에도 적극 나설 계획이다. 올해 국내에 출시한 당뇨병 치료제 신약 슈가논은 중국 인도 러시아 등지에서 임상에 착수했다. 항생제 시벡스트로는 2014년 6월 FDA 승인을 받은 데 이어 지난해에는 유럽식품의약품청(EMA)에서 판매 허가를 따냈다.
강 사장은 “연구개발(R&D) 역량을 강화해 바이오, 합성, 천연물 등에서 다수의 글로벌 신약을 확보하려 한다”며 “신약 기술 수출 등 가시적인 성과도 곧 나올 수 있을 것”이라고 말했다.
박영태 기자 pyt@hankyung.com
-
기사 스크랩
-
공유
-
프린트
![2023년 주요 유니콘 기업 실적 분석 [인포그래픽]](https://img.hankyung.com/photo/202404/01.36470444.3.jpg)

![미국 시장 진출한 뉴빌리티…누비랩, 지구의 날 기념 챌린지 진행 [Geeks' Briefing]](https://img.hankyung.com/photo/202404/01.36470403.3.jpg)


![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)