셀트리온 "10월부터 램시마 미국 판매"
미국 법원 "원조의약품 특허 무효"
얀센 항소해도 승소 가능성 낮아
셀트리온 "연 매출 2조원 기대"

○특허침해 소송에서 승소
미국 매사추세츠 연방법원은 17일(현지시간) 존슨앤드존슨 자회사 얀센의 류머티즘 관절염 치료제 레미케이드의 물질특허가 유효하지 않다고 판결했다. 램시마 출시의 걸림돌이었던 오리지널 제약사의 특허 침해 주장에 대해 미 법원이 셀트리온의 손을 들어줬다.
얀센은 지난해 3월 셀트리온의 램시마가 오리지널 의약품인 레미케이드의 물질특허를 침해했다며 특허침해 소송을 제기했다. 물질특허는 바이오의약품의 제조 물질에 부여하는 원천기술에 대한 특허다. 이 때문에 램시마의 미국 출시 일정이 지연될 수 있다는 지적이 나왔다.
미국 공중보건서비스법에 따라 바이오시밀러 개발자는 오리지널 의약품 제조사에 시판 180일 전에 판매 사실을 고지해야 한다. 지난 4월5일 미국 식품의약국(FDA) 판매 허가를 받은 램시마는 오는 10월3일부터 시장에서 판매할 수 있다. 하지만 얀센의 특허침해 소송이 변수가 됐다. 오리지널인 레미케이드의 특허가 인정되면 램시마 출시가 무기한 연기될 수 있기 때문이다.
얀센은 항소하겠다는 뜻을 밝혔다. 그러나 얀센 승소 가능성은 높지 않다는 분석이 나온다. 지난해 2월 미국 특허청이 레미케이드 특허 재심사에서 특허 거절을 통보했기 때문이다. 레미케이드 성분 항체를 배양하기 위한 배지에 관한 특허가 남아있지만 큰 문제는 되지 않을 것이라는 게 셀트리온 측 설명이다.
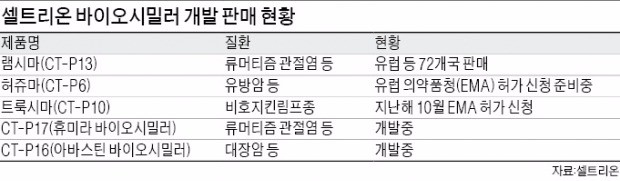
이번 승소로 한국 바이오시밀러가 미국 시장 진출을 눈앞에 두게 됐다. 셀트리온 램시마는 세계 최초 항체 바이오시밀러이자 자가면역질환 치료제다. 미국에서 시판 허가를 받은 첫 번째 항체 바이오시밀러이기도 하다. 2012년 7월 한국 식품의약품안전처를 통해 시판 허가를 받았고 2013년 8월 유럽의약품청(EMA)으로부터 판매 허가를 얻었다.
○미국서 연 2조원 매출 기대

이 중 레미케이드는 세계 시장 규모가 12조원이다. 미국은 5조4000억원 규모다. 램시마는 FDA로부터 류머티즘 관절염, 강직성척추염, 성인궤양성대장염, 크론병, 건선 등 레미케이드로 치료할 수 있는 모든 질환에 동일한 효능을 갖고 있다고 인정받았다.
가격 경쟁력도 높다. 바이오시밀러는 오리지널 의약품보다 약값이 싸다. 의료비용을 줄이기 위한 각국 정부에서 사용을 늘리는 이유다. 램시마는 유럽에서 오리지널 의약품 시장의 30% 이상을 점유했다. 이 때문에 셀트리온은 램시마로 미국에서 한 해 2조원 규모의 매출을 거둘 수 있을 것으로 기대하고 있다.
이지현/조미현 기자 bluesky@hankyung.com
-
기사 스크랩
-
공유
-
프린트