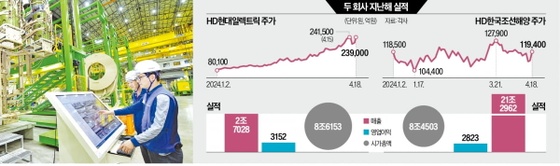
95년부터 "의약품 재심사제도" 시행...보사부
위해 오는 95년 1월1일부터 "의약품 재심사제도"를 도입, 실시하기로 했다.
새로 실시될 이 제도는 신약으로 제조허가를 받은 모든 의약품에 대해
6년이 경과한 날로 부터 3개월이내에 그동안의 시판과정에서 나타난
부작용,임상결과 등을 토대로 유효성 및 안전성에 관한 자료를 의무적으로
작성,제출토록 해재심사를 실시하는 것을 골자로 하고 있다.
보사부는 재심사 결과 약효가 떨어지고 안전성에 문제가 있는 것으로
판명될 경우 품목제조허가나 품목변경등의 행정조치를 취하고 재심사 대상
품목에는 수입의약품도 포함시키기로 했다.
보사부는 신약을 재심사하는 동안 다른 업체에서 동일 품목을
제조하고자할 경우에는 최초 제조허가자가 신약허가시 제출했던 동일한
임상자료를 제출토록 했다.
신약이란 대한약전이나 공정서에 올라있지 않은 것으로 국내에서 이미
허가된 의약품과는 화학구조 또는 본질조성이 다른 신물질과 이를
유효성분으로 함유한 의약품을 말한다.
신약제조 허가시 필요한 첨부자료로는 <> 기원,발견 및 개발경위에
관한 자료 <>구조,결정,물리화학적 성질에 관한 시험자료 <> 안전성에
관한 자료 <> 독성에 관한 시험자료 <> 효력시험에 관한 자료 <>
일반약리에 관한 자료<>흡수,분포,대사 및 배설에 관한 시험자료 <>
임상시험 성적자료(3개이상 임상시험 지정의료기관에서 각 30예 이상)등이
있다.
-
기사 스크랩
-
공유
-
프린트
![[포토] 美 보스턴서 돌아온 사리 친견하는 스님들](https://img.hankyung.com/photo/202404/AA.36471428.3.jpg)
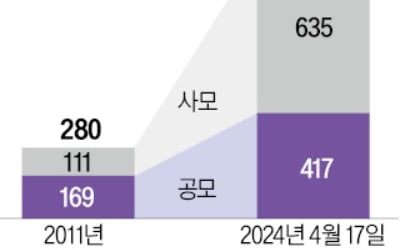


![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)