브릿지바이오, 'BBT-401' 유효성 입증 실패…세부지표 살펴보니
2a상 플라시보 투여군 반응률이 더 높아
대웅제약, 아시아 개발권 보유
먹는 궤양성 대장염 약 임상서 유효성 확보 실패
19일 업계에 따르면 브릿지바이오는 지난 17일 궤양성대장염 신약 후보물질 'BBT-401'의 2a상 임상시험에서 통계적 유효성을 확인하지 못했다고 공시했다.BBT-401는 브릿지바이오에서 개발하고 있는 먹는 궤양성대장염 치료제 후보물질이다. 하루 한번 복용하는 펠리노-1 저해제다. 약을 먹어도 소화관에만 머물도록 설계돼 먹는 약을 복용할 때 생기기 쉬운 전신 부작용을 해소할 수 있을 것으로 업체 측은 기대하고 있다.
브릿지바이오는 앞서 미국에서 이 후보물질을 저용량으로 투여하는 임상시험을 한 뒤 대장 말단까지 약물이 잘 가도록 전달률을 높인 제형으로 추가 임상시험을 진행해왔다. 이번에 결과를 공개한 다국가 2상 임상시험이다.
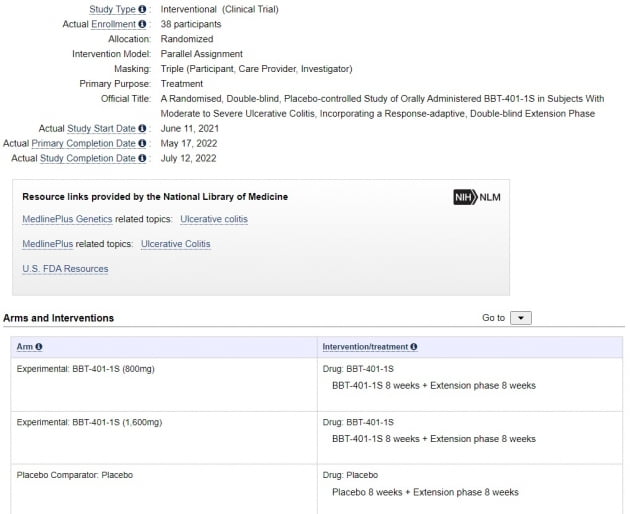
해당 임상시험은 한국과 미국 뉴질랜드 폴란드 우크라이나 등 5개 나라 37개 기관에서 이뤄졌다. 미국 임상정보사이트인 클리니컬트라이얼즈에 따르면 2021년 6월 11일 시작돼 지난해 7월 12일 마지막 투여 환자 관찰 절차가 마무리됐다.
가짜약서 임상적 반응율이 더 높아
이번 임상시험은 38명의 환자를 세 그룹으로 나눠 가짜약과 중용량(800mg), 고용량(1600mg)을 16주간 투여하는 방식으로 이뤄졌다. 1차 지표는 8주 간 치료를 한 뒤 임상적 반응률이다. 메이요 점수가 기준선보다 3점 이상 줄거나 30% 이상 개선된 환자의 비율이다. 환자의 직장출혈 증상도 개선돼야 한다.메이요 점수는 궤양성 대장염의 증상을 파악하기 위한 도구다. 대변 빈도, 직장출혈, 내시경 검사상 소견, 의사의 증상평가 등 4개 항목에 0~3점까지 점수를 매긴 뒤 이를 더해 0~12점까지 점수를 준다. 점수가 높을수록 증상이 심각하다는 의미다.
임상시험 결과 중용량을 투여한 환자와 고용량을 투여한 환자의 임상적 반응률은 모두 54.5%였다. 절반이 넘는 환자에게서 메이요 점수가 떨어지거나 증상이 개선됐다는 의미다. 하지만 가짜약을 투여한 환자군에선 이 비율이 63.6%로 더 높았다. 가짜약 대비 약효를 입증하지 못한 것이다.
이상반응은 대부분 가벼운 수준인 데다 약물 관련 이상반응은 없었다. 앞선 1상시험과 저용량을 투여한 이전 2상시험에서 확인한 안전성이 다시 한 번 확인됐다고 업체 측은 설명했다.
브릿지바이오는 "지난 저용량군 시험 대비 개선된 약물 검출 결과를 확인해 제형 개선을 통한 약물 전달능 강화 측면에서 소기의 성과를 달성했다"며 "추가 진행할 제형 개선 방향성을 명확히 하는 데 중요한 발판이 될 것"이라고 했다.
브릿지바이오는 2018년 12월부터 대웅제약과 함께 BBT-401를 개발하고 있다. 대웅제약은 한국과 중국 일본 동남아시아 등 22개 나라의 사업권을 확보하는 조건으로 브릿지바이오에 전략적 투자를 했다.
개발을 마치면 브릿지바이오가 대웅제약으로부터 받게 되는 금액은 4000만달러다. 지난해 11월 대웅제약은 중국 임상 1상 시험이 끝난 데 대한 마일스톤으로 브릿지바이오에 150만 달러를 지급했다.
궤양성 대장염은 대장 점막이나 점막 아래 층에 염증이 생기는 질환이다. 10~30대 젊은 환자가 많다. 증상이 약한 환자는 메살라민 등과 같은 항염증제를, 심한 환자는 스테로이드제제를 주로 활용한다. 면역억제제 등 생물학적 제제도 치료제로 활용되고 있다.
1차 치료제인 항염증제는 증상이 완화되다가 재발해 약효가 다소 떨어진다. 장기복용 시 부작용이 생길 것을 우려해 환자 치료에 스테로이드 제제를 폭넓게 쓰는 데에도 한계가 있다. 생물학적제제는 주사제인 데다 가격이 비싸다. JAK억제제인 화이자의 '젤잔즈' 등이 먹는 궤양성 대장염 치료제로 승인 받았지만 혈전증 등 부작용 위험 탓에 시장이 다소 위축된 상태다. 새로운 먹는 치료제에 대한 수요가 높은 이유다.
이지현 기자 bluesky@hankyung.com
**이 기사는 바이오·제약·헬스케어 전문 사이트 <한경 BIO Insight>에 2023년 2월 19일 18시 23분 게재됐습니다.
-
기사 스크랩
-
공유
-
프린트













![[오늘의 arte] 독자 리뷰 : 당신의 미술 취향은 무엇인가요](https://timg.hankyung.com/t/560x0/photo/202404/AA.36523699.3.jpg)