[분석+]美 FDA CRL 받은 한미약품 포지오티닙, 경쟁약물 살펴보니…
올해 9월 미국 식품의약국(FDA) 산하 종양약물자문위원회가 포지오티닙의 신약 허가 유용성이 낮다고 판단한 뒤 하나증권은 이 약의 가치를 절반 수준으로 하향조정했다. 가속승인이 불발돼 임상 3상시험을 거치게 되면 허가 일정이 2년 가량 늦어질 것이란 판단에서다.
포지오티닙은 2015년 한미약품이 미 제약사 스펙트럼파마슈티컬스에 기술수출한 약이다. 포지오티닙이 표적으로 삼은 시장에 경쟁자가 늘어나는 것도 시장성엔 악재가 되고 있다. '엔허투'라는 강력한 경쟁자까지 시장에 진입했다.
EGFR 변이 4~10%가 엑손20 삽입 변이
비소세포폐암 환자를 위한 엑손20 삽입 변이 표적치료제 개발에 글로벌 제약사들이 역량을 집중하고 있다. 기존 표적 항암제의 한계를 극복할 수 있을 것으로 평가받으면서다.
전통적으로 폐암 환자의 1차 치료제는 백금 화학요법이었다. 이후 EGFR 변이가 확인되고 티로신키나아제라는 효소 작용을 막는 티로신키나아제억제제(TKI)가 개발되면서 비소세포폐암(NSCLC) 환자를 위한 표적 치료제 시대가 열렸다.
NSCLC 환자 중 EGFR 변이가 있는 환자는 30% 정도다. 이들에게 EGFR-TKI는 표준치료법으로 자리잡았다. 다만 EGFR-TKI에도 한계가 있다. 엑손20삽입(Exon 20 Insertion) 변이가 있는 환자에겐 EGFR-TKI가 잘 듣지 않기 때문이다.
전체 EGFR 돌연변이 환자 중 46%는 EGFR 엑손19결손 환자다. 36%는 EGFR L858R 변이를 갖고 있다. 엑손20삽입 돌연변이 환자는 EGFR 변이환자의 4~10% 정도다. 기존 EGFR-TKI 중 엑손20삽입 변이 환자에게 효과를 낸 약은 없었다. 글로벌 제약사들이 앞다퉈 엑손20삽입 변이가 있는 NSCLC 환자를 위한 치료제 개발에 나선 이유다.
지난해 FDA 새 표적치료제 승인
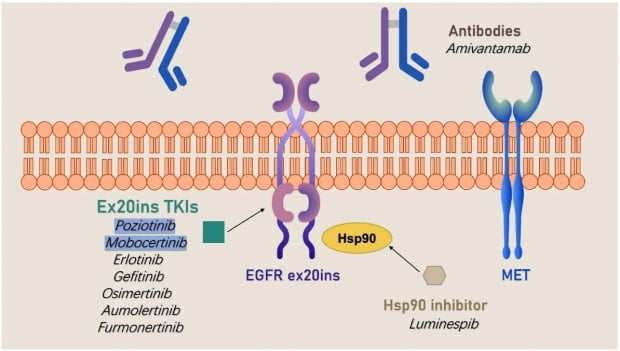
아미반타맙은 지난해 5월 리브레반트라는 상품명으로, 모보세니팁은 지난해 9월 엑스키비티라는 상품명으로 각각 FDA 시판 승인을 받았다. 리브레반트는 EGFR과 MET수용체를 타깃으로 삼은 이중특이항체치료제다. 엑스키비티라는 TKI계열 치료제다.
EGFR 엑손20삽입 변이 타깃 치료제 중 후기 임상 궤도에 오른 대표 제품은 리브레반트, 엑스키비티, 포지오티닙이다.
리브레반트는 FDA 승인을 위해 제출한 서류에서 EGFR 엑손20삽입 변이 환자의 생존기간 중앙값(mOS)이 22.8개월이라고 보고했다. 객관적반응률(ORR)은 40%, 무진행생존기간 중앙값(mPFS)은 8.3개월이다. 3등급이 넘는 이상반응을 호소한 환자는 35%였다.
엑스키비티는 미 FDA 허가를 위해 114명의 EGFR 엑손20삽입 변이 환자 데이터를 제출했다. 지난해 미임상암학회(ASCO)에서 발표된 데이터에 따르면 ORR은 28%, mOS는 24개월, mPFS은 7.3개월이었다.
안전성 이슈는 기존 EGFR-TKI와 크게 다르지 않았다. 용량조절이 필요한 이상반응(AE)을 호소한 환자는 22~25%였다. 환자의 10~17%는 이상반응 탓에 치료를 중단했다. 3등급이 넘는 이상반응을 호소한 환자는 69%였다.
포지오티닙은 EGFR 엑손20삽입 변이 환자를 대상으로 한 연구에서 ORR 14.8%, mPFS 4.2개월 등 실망스런 성적을 냈다. 리브레반트와 엑스키비티의 후속주자인 포지오티닙이 기존 약물 대비 큰 경쟁력을 내기 어려울 것이란 전망이 나온 이유다.
![[분석+]美 FDA CRL 받은 한미약품 포지오티닙, 경쟁약물 살펴보니…](https://img.hankyung.com/photo/202211/01.31927971.1.jpg)
스펙트럼과 한미약품은 포지오티닙을 HER2 엑손20삽입 변이 표적 치료제로 개발하는 데 집중했다. 지난해 말 미 FDA에 가속 사용승인을 요청했던 적응증도 HER2 엑손20삽입 변이NSCLC이다. HER2 변이 환자는 NSCLC환자의 2~4% 정도다. 상당수가 엑손20삽입 변이 환자다.
스펙트럼이 FDA 제출한 데이터는 HER2 엑손20삽입 변이 환자 90명을 대상으로 한 임상결과다. 포지오티닙은 ORR 27.8%, mOS 5.1개월, mPFS 5.5개월이었다. 3등급이 넘는 이상반응을 호소한 환자는 85%였다. 이런 이유로 57%가 용량을 줄여야 했다.
이런 결과를 토대로 FDA 종양약물자문위원회(ODAC)는 지난 9월 'HER2 엑손 20 삽입 변이 NSCLC 환자 치료에 포지오티닙을 사용하는 것은 유용성이 낮다'고 판단했다. 자문위원 13명 중 9명이 포지오티닙의 위험 대비 효과가 높지 않다고 판단했다.
올해 ASCO에서 기립박수를 받은 아스트라제네카-다이이찌산쿄의 엔허투가 HER2 엑손20삽입 변이 NSCLC 환자에게 고무적 성과를 낸 것도 부담이다. 폐암 환자를 대상으로 한 DESTINY-Lung01 임상 2상에서 엔허투의 ORR은 54.9%, mPFS는 8.2개월, mOS는 17.8개월이었다. 이상반응으로 폐렴을 호소한 환자는 26%였다.
올해 8월 미 FDA가 엔허투를 가속승인하면서 검토했던 DESTINY-Lung02는 성적이 좀더 좋았다. ORR은 57.7%, 반응지속기간 중앙값(mDoR)은 8.7개월이다. 포지오티닙의 mDoR은 5.1개월이다.
이지현 기자 bluesky@hankyung.com
-
기사 스크랩
-
공유
-
프린트







![[단독]하이브 키운 '멀티 레이블'이 제 발등 찍었다](https://timg.hankyung.com/t/560x0/photo/202404/02.33877838.1.jpg)



