FDA 자문위, 비소세포폐암藥 ‘포지오티닙’ 승인 반대 권고
美 스펙트럼이 한미약품서 도입
22일(현지시간) ODAC는 포지오티닙의 품목허가 권고 여부를 결정하기 위해 회의를 진행했다. ODAC 위원들은 비소세포폐암 환자의 치료를 위한 포지오티닙 사용의 이득(benefit)이 위험(risk)보다 크지 않다는 의견에 9대 4로 동의했다.
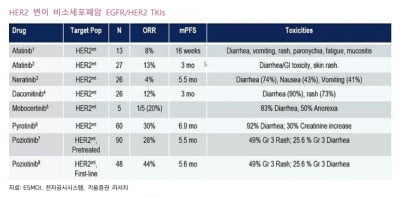
포지오티닙은 먹는(경구용) 비소세포폐암 치료제다. 한미약품이 개발하고, 이를 도입한 협력사 스펙트럼 파마슈티컬스가 작년 12월 FDA에 가속승인을 신청했다. 적응증은 치료 경험이 있고 국소 진행 및 전이성 ‘HER2 Exon 20’ 삽입 변이가 있는 비소세포폐암의 치료다.
앞서 FDA는 브리핑 문서를 통해 몇 가지 우려를 제기했다. 포지오티닙이 현재 이용 가능한 치료 방법에 비해 이점을 나타내기 불분명하다고 했다. 투여로 인한 이상반응이 높다는 점도 언급했다.
FDA는 처방의약품신청자수수료법(PDUFA)에 따라 오는 11월 24일까지 포지오티닙의 품목허가 여부를 결정해야 한다. 자문위 권고는 구속력은 없지만, FDA는 통상적으로 자문위의 권고를 따른다.
하나증권은 포지오티닙의 가속승인 확률이 높지 않을 것으로 봤다. 2008년부터 2015년 자문위에서 부정적 권고를 받은 110건 중 FDA가 허가한 경우는 22건에 불과하다고 했다.
포지오티닙에 대한 가속승인이 어려워진 만큼 임상 3상 진행 후 2024년 정식 품목허가 신청, 2025년 출시를 예상했다. 이를 반영해 한미약품의 목표주가를 33만원으로 낮췄다. 투자의견 ‘매수’는 유지했다.
박재경 하나증권 연구원은 “ODAC가 포지오티닙의 승인에 대해 최종적으로 반대를 권고하며 가속승인 확률은 낮아졌다”며 “포지오티닙 현재 가치를 기존의 1100억원에서 450억원으로 하향 조정했다”고 말했다.
박인혁 기자 hyuk@hankyung.com
-
기사 스크랩
-
공유
-
프린트




![하루 만에 550조원 증발…실적·물가 압력에 기술주 투매 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240206081554930.jpg)


![[단독] "경영보다 돈"…아워홈 매각 손잡은 남매](https://timg.hankyung.com/t/560x0/photo/202404/AA.36472890.1.jpg)





![[신간] 로마 제국이 '최고 국가'로 우뚝 서기까지…'팍스'](https://timg.hankyung.com/t/560x0/photo/202404/ZK.36477517.3.jpg)