“한미약품, ‘롤론티스’ FDA 허가로 ‘랩스커버리’ 기술력 입증”
13일 증권가에선 한미약품의 플랫폼 기술이 적용된 치료제의 미국 허가로 기술 경쟁력을 입증한데다, 평택 바이오공장의 제조 및 품질관리 능력 또한 인정받았다고 평가했다.
롤론티스는 한미약품의 약효 지속성 기술 ‘랩스커버리’가 적용된 바이오신약이다. 2007년 연구를 시작한 후 2012년 1월 2억4000만달러 규모로 스펙트럼에 기술이전했다. 스펙트럼은 한국 중국 일본을 제외한 세계 판권을 갖고 있다. 2018년부터 세 번의 FDA 신약허가 심사에 걸쳐 이번에 승인됐다.
임윤진 대신증권 연구원은 “랩스커버리 신약의 첫 FDA 시판허가로, 한미약품의 연구개발 기술력을 입증했다”며 “평택 바이오공장의 성공적인 FDA 실사 완료는 후속 랩스커버리 후보물질 개발에서 긍정적으로 작용할 것”이라고 말했다.
롤론티스는 오는 4분기에 미국에서 출시될 예정이다. 기존 약물 대비 경쟁력 있는 임상 결과를 바탕으로, 빠르게 시장 점유율을 확대할 것이란 예상이다. 임 연구원은 “현재 당일 투여요법 미국 임상 1상을 진행 중”이라며 “향후 임상 결과에 따라 추가 경쟁력을 확보할 것으로 기대한다”고 했다.
허혜민 키움증권 연구원은 “스펙트럼의 임상 디자인은 기존 치료제 ‘뉴라스타’ 대비 비열등성으로 설계돼, 효능보다는 우수한 상대적 위험 감소율과 가격 경쟁력으로 시장에 침투할 것으로 예상된다”고 말했다. 이어 “국내에서는 작년 4분기부터 처방되고 있으며, 올해 매출은 약 30억원으로 추정한다”고 덧붙였다.
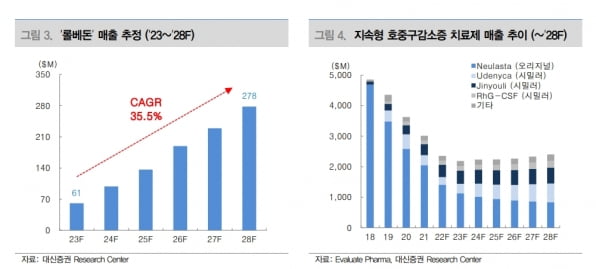
내년 롤론티스의 미국 매출을 시장 점유율 약 2% 수준인 6000만달러로 추정하면, 한미약품으로 유입될 로열티는 생산 마진을 제외하고 약 40억원일 것이란 추산이다. 임 연구원은 “출시 후 3년 동안 순매출 대비 7%, 4년차부터 15% 수준의 로열티를 받을 것으로 추정한다”며 “이를 바탕으로 2025년부터 본격적인 수익 확대가 가능할 것”이라고 판단했다.
허 연구원은 “2026년엔 약 200억원의 로열티 유입이 예상된다”며 “롤론티스의 원료의약품(DS)도 공급하기 때문에 원료 매출도 추가될 것”이라고 했다.
오는 11월 24일엔 'HER2 엑손20' 삽입 변이 비소세포폐암 치료제 ‘포지오티닙’의 승인 결정도 예정돼 있다. 포지오티닙의 내년 매출은 5200만달러(약 722억 원)로, 중간 한 자릿수 로열티인 5% 적용하면 25억원의 로열티가 유입될 것이란 추정이다.
허 연구원은 “롤론티스와 포지오티닙 두 제품을 합산한 내년 유입 예상 마일스톤은 68억원으로 크지 않다”며 “하지만 랩스커버리 플랫폼이 적용된 첫 신약의 미국 출시와 임상부터 상용화 제품 생산까지의 경험, FDA 공장 실사 노하우가 쌓였다는 점에서 후속 파이프라인의 원활한 진행을 전망해볼 수 있다”고 말했다.
-
기사 스크랩
-
공유
-
프린트













![[오늘의 arte] 독자 리뷰 : 당신의 미술 취향은 무엇인가요](https://timg.hankyung.com/t/560x0/photo/202404/AA.36523699.3.jpg)