KAIST 연구팀, 염증 없이 아밀로이드 잡는 기술 개발…"알츠하이머 치료 길 찾았다"
김찬혁 KAIST 부교수와 정원석 KAIST 부교수팀은 알츠하이머병의 원인으로 꼽히는 아밀로이드베타 단백질을 효율적으로 제거하면서도 신경독성을 일으키는 염증 부작용은 최소화하는 융합단백질체(항Aβ-Gas6)를 개발했다고 9일 밝혔다.
연구결과는 네이처 자매지 ‘네이처 메디슨’ 4일자에 실렸다. 김 교수와 정교수는 알츠하이머병 치료제를 개발하는 국내 신약벤처 일리미스테라퓨틱스의 공동창업자이기도 하다.
미국 바이오젠의 아두헬름은 미국 식품의약국(FDA)의 첫 승인을 받은 알츠하이머병 치료제이지만 의료현장에서 널리 쓰이지 못하고 있다. 효능과 부작용 모두가 불확실하기 때문이다.
FDA가 이 약을 승인하는 데 근거가 된 임상시험(ENGAGE)에서도 아밀로이드베타 단백질이 모인 아밀로이드 플라크는 효과적으로 제거가 잘 됐지만 정작 1차 평가변수였던 인지행동은 개선되지 않았다. 부작용 문제도 컸다. ‘아밀로이드베타 관련 영상이상(aria)’라 부르는 염증과 출혈 및 부종 문제로 최소 4명의 투약 환자가 사망했다.
연구팀은 아두헬름이 아밀로이드 플라크는 효과적으로 제거했음에도 알츠하이머 환자의 인지능력을 개선하지 못한 원인을 식세포과정에서 생기는 염증에서 찾았다. 아두헬름 같은 항체치료제가 몸 속에 투여될 때 생기는 현상이다. 아두헬름은 뇌 속 대식세포라 할 수 있는 미세아교세포(microglia)를 이용해 아밀로이드 단백질을 제거하는데, 이 과정에서 발생한 염증반응 때문에 신경세포와 시냅스의 손상이 일어난다는 것이다.
연구팀은 미세아교세포의 염증반응을 유도하는 fc 수용체 대신 TAM 식세포 수용체를 자극하는 ‘Gas6’ 단백질을 이용했다. TAM 식세포 수용체는 미세아교세포와 성상세포(astrocyte)에 모두 존재하는데 염증반응 없는 '사멸세포인식 및 포식작용(efferocytosis)'을 유도한다. 연구팀은 여기에 아밀로이드 단백질을 인식할 수 있는 항 아밀로이드 단백질 항체의 일부를 붙였다.
요약하면 아밀로이드 단백질이 염증반응을 동반하는 미세아교세포의 식세포작용이 아닌 미세아교세포와 성상세포의 사멸세포 인식 및 포식작용을 통해 제거되도록 했다.
연구팀은 “뇌내 면역세포를 전체로 따져보면 미세아교세포보다 성상세포가 더 많기 때문에 더 많은 면역세포를 이용해 염증반응 없이 아밀로이드 단백질을 제거할 수 있다”고 설명했다.
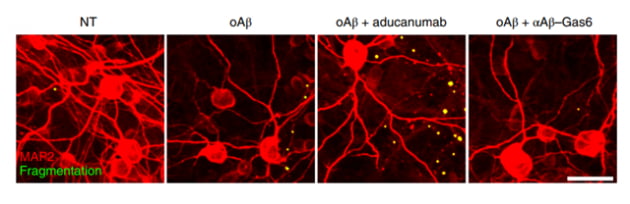
아두헬름을 투여했을 때는 염증을 나타내는 노란 점이 더 많아졌다. 반대로 항Aβ-Gas6을 투여했을 때는 노란 점이 거의 없었다. 연구팀은 “항Aβ-Gas6가 염증과 미세 출혈을 악화시키지 않고 아밀로이드 베타를 제거하는 데 효과적인 치료제라는 점을 보여주는 결과”라고 설명했다.
연구팀은 Gas6에 항Aβ 단백질 외에도 다양한 단백질을 붙여 다양한 표적 단백질을 제거할 수 있어 플랫폼 기술이라고 소개했다. 연구팀은 알츠하이머병의 또 다른 원인으로 주목되는 타우(tau) 단백질을 제거할 수 있도록 Gas6에 항 tau를 붙인 후보물질도 새롭게 개발한다는 계획이다.
박상훈 일리미스테라퓨틱스 대표는 “내년 상반기 중 후보물질 최적화를 마친 뒤 하반기 중 전임상에 진입할 것”이라고 말했다.
이우상 기자 idol@hankyung.com
-
기사 스크랩
-
공유
-
프린트
![[책마을] 평생 먹는 알약만 5만개…어쩌다 '약 권하는 사회'가 됐나](https://img.hankyung.com/photo/202011/AA.24402303.3.jpg)




![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)


![[단독] "경영보다 돈"…아워홈 매각 손잡은 남매](https://timg.hankyung.com/t/560x0/photo/202404/AA.36472890.1.jpg)





