“뉴지랩파마, 4세대 대사항암제 조기 상업화·기술이전 기대”
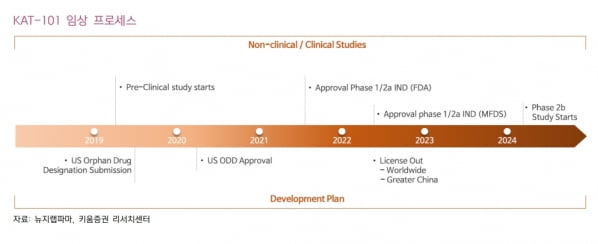
뉴지랩파마의 ‘KAT-101’은 지난해 8월 미국 식품의약국(FDA)에 이어 올 4월 국내 식품의약품안전처로부터 1·2a상을 승인 받았다. 현재 임상윤리위원회(IRB) 심사 중으로, 이달 환자 모집이 가능할 것으로 봤다.
허혜민 연구원은 “KAT-101은 다수의 전임상 동물실험과 미국암학회(AACR) 췌장암 데이터 발표, 간암 흑색종 방광암 등 응급임상 치료사례를 통해 안전성과 유효성을 검증했다”고 말했다.
조기 상업화와 기술이전을 기대했다. KAT-101은 간암 흑색종을 대상으로 FDA의 희귀의약품 지정(ODD)을 받아, 2상 이후 조건부 승인을 통한 상업화가 가능할 것이란 판단이다.
또 공개(오픈라벨) 방식의 임상으로 8주마다 데이터를 확인할 수 있다. 임상 진행 중에도 유의미한 데이터 발표로 조기 기술이전을 기대할 수 있다고 봤다.
허 연구원은 “FDA로부터 유일하게 승인받은 대사항암제인 아지오스의 ‘아이드하이파’는 지난해 12월 프랑스 제약사 사비어에 20억달러(약 2조6000억원) 규모로 인수됐다”며 “고형암을 표적하는 KAT-101의 적응증 확장성을 고려한다면, 더 큰 잠재 가치를 보유하고 있다”고 판단했다.
글로벌 2상은 미국과 일본에서 안허트가, 중국에서 이노벤트가 진행하고 있다. 경쟁 후보물질로는 FDA의 허가를 받은 ‘잴코리’, ‘로즐리트렉’, 2상을 진행 중인 ‘레포트렉티닙’이 있다. 이 중 레포트렉티닙은 지난 6월 BMS가 터닝포인트를 41억달러(약 5조3000억원)에 인수하게 된 주요 자산이었다. BMS는 내년 하반기 FDA 승인을 기대하고 있다.
허 연구원은 “2차 치료제에서 1차 치료제 시장까지의 확대를 기대하는 만큼, 이보다 더욱 우수한 데이터를 확보하고 있는 탈레트렉티닙의 가치에 주목해야할 시점”이라고 했다.
김예나 기자 yena@hankyung.com
-
기사 스크랩
-
공유
-
프린트



!['매그니피센트7' 실적 먹구름…지수 혼조 [뉴욕증시 브리핑]](https://timg.hankyung.com/t/560x0/photo/202404/01.36519299.1.jpg)







