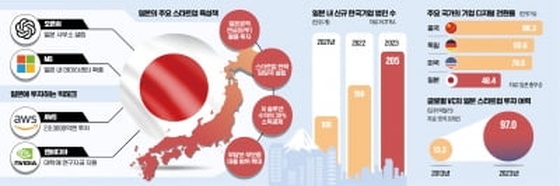
MSD, ‘키트루다’ 진행성 자궁내막암 단독요법 FDA 승인
객관적반응률 46%
MSD는 ‘KEYNOTE-158’ 연구 중 일부 환자군(코호트)의 결과를 기반으로 적응증 확장을 승인받았다. MSI-H 또는 dMMR 양성인 진행성 자궁내막암 환자에 키트루다를 투여한 결과 객관적반응률(ORR)은 46%를 기록했다. 완전 관해율(CR)와 부분관해율(PR)은 각각 12%와 33%였다.
이번 승인으로 키트루다는 자궁내막암에 대한 두 번째 적응증을 획득했다. 이전에는 키트루다와 렌비마의 병용 요법으로 전신 요법 후에 근치적 수술(curative surgery) 혹은 방사선 치료 대상이 아닌 진행성 자궁내막암 치료에 대해 승인됐다.
키트루다는 ‘PD-1’과 그 리간드인 ‘PD-L1’ 혹은 ‘PD-L2’간의 상호작용을 차단해 면역관문을 억제하고 면역세포를 활성화시키는 항체치료제다. 2014년 진행성 흑색종 환자 치료를 위해 승인된 이후 적응증을 확장해왔다.
현재 비소세포폐암과 두경부편평세포암, 전형적 호지킨림프종(cHL), 원발성 종격동 B세포 림프종(PMBCL), 요로상피암, 비근육침윤성방광암 등을 포함한 다수의 암종에 사용할 수 있다. MSD는 적응증을 확장하기 위해 다양한 암종 및 치료 환경에 대해 1700건 이상의 임상을 진행 중이다.
박인혁 기자
-
기사 스크랩
-
공유
-
프린트





![[단독]하이브 키운 '멀티 레이블'이 제 발등 찍었다](https://timg.hankyung.com/t/560x0/photo/202404/02.33877838.1.jpg)