헬릭스미스 "2023년부터 신약 동시다발 임상"
엔젠시스, 2년내 품목허가 계획
다른 치료제도 임상 진입 예정
"유전자세포치료제 위탁생산시설
이달 준공…年 매출 100억 목표"

헬릭스미스 경영진이 엔젠시스 의존도를 낮추는 데 힘을 쏟기로 한 이유다. 유승신 헬릭스미스 대표는 15일 온라인 기자간담회를 열고 엔젠시스를 제외한 8개 신약 후보물질을 이른 시일 내에 임상 1상 단계에 올려놓겠다고 밝혔다. 또 유전자 치료제 위탁개발생산(CDMO) 사업을 ‘캐시카우(현금창출원)’로 키운다는 청사진도 내놨다.
“8개 파이프라인 본격 임상 가동”
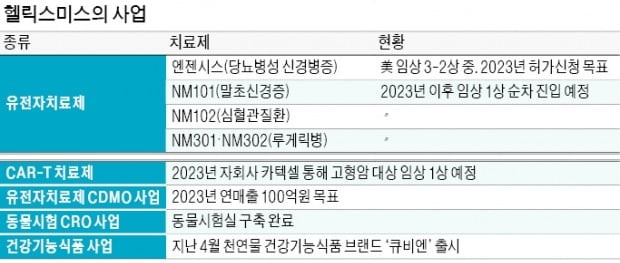
CAR-T 치료제는 2023년 자회사 카텍셀을 통해 신경모세포종 등 고형암을 대상으로 한 임상 1상을 추진하기로 했다. 헬릭스미스는 △엔젠시스를 제외한 DNA 기반 후보물질 2개 △아데노바이러스 기반 후보물질 2개 △CAR-T 후보물질 4개를 보유하고 있다.
헬릭스미스가 임상 대상을 늘리는 건 엔젠시스 의존도를 떨어뜨리기 위해서다. 사업 포트폴리오를 확대해야 위험을 분산할 수 있다는 판단에서다.
여윳돈이 있다는 점도 공격적인 임상계획에 영향을 미쳤다. 서제희 헬릭스미스 전략기획본부장은 “2000억원이 넘는 현금 및 현금성 자산을 확보하는 등 충분한 유동성을 갖췄다”며 “내년에 계획한 임상을 예정대로 끝내도 1000억원이 넘는 현금성 자산이 남을 것”이라고 말했다.
엔젠시스에 대해선 2023년까지 임상 3상을 끝내고 미국 품목허가를 신청하기로 했다. 이 회사는 엔젠시스의 두 번째 임상 3상을 미국에서 진행하고 있다.
유전자 치료제 CDMO 진출
신사업으로 추진하고 있는 유전자 치료제 CDMO 사업도 조만간 궤도에 오를 전망이다. 이 회사는 지난 13일 서울 마곡동에 있는 유전자치료제 생산시설 준공식을 열었다. 유전자 치료제 CDMO 사업에서 내년 2~3월에 첫 매출을 낸 뒤 이르면 2023년 연매출 100억원을 내는 게 목표다. 국내 40여 개 바이오 기업이 잠재 고객이다.유전자 치료제 CDMO 사업은 삼성바이오로직스 등 다른 바이오 기업들도 추진 중이다. 유전자 치료제를 직접 개발했던 경험을 적극 살리면 차별화가 가능하다는 게 헬릭스미스 측의 판단이다. 서 본부장은 “20년 이상 유전자 치료제를 개발하면서 개발사 입장에서 신약 개발의 어려움이 어디서 생기는지를 알고 있다는 게 강점”이라며 “자회사의 CAR-T 치료제 임상 제품을 공급할 때도 이 생산시설을 활용할 수 있다”고 설명했다.
자체 전임상에 사용했던 동물시험 시설도 임상수탁기관(CRO) 사업에 활용해 수익원을 다각화하기로 했다. 이 회사는 지난 4월 천연물 기반 건강기능식품 브랜드인 ‘큐비엔’도 출시했다. 그간 내수용 원료 공급 위주로 진행했던 건강기능식품 사업을 완제품 공급 중심으로 전환하기 위한 취지다.
이주현 기자 deep@hankyung.com
-
기사 스크랩
-
공유
-
프린트



![하루 만에 550조원 증발…실적·물가 압력에 기술주 투매 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240206081554930.jpg)


![[단독] "경영보다 돈"…아워홈 매각 손잡은 남매](https://timg.hankyung.com/t/560x0/photo/202404/AA.36472890.1.jpg)





![[신간] 로마 제국이 '최고 국가'로 우뚝 서기까지…'팍스'](https://timg.hankyung.com/t/560x0/photo/202404/ZK.36477517.3.jpg)