셀리버리, 코로나19 치료제 유럽 임상 국가 폴란드로 확정
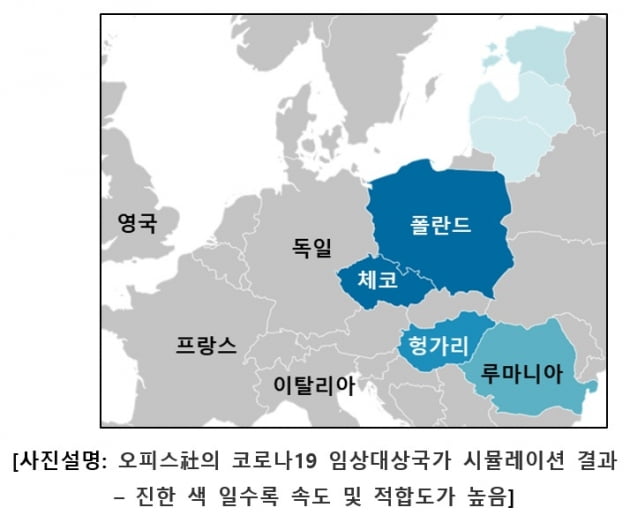
셀리버리는 지난달 유럽 임상시험수탁기관(CRO)인 오피스와 계약 이후, 미국에서 도출된 비임상시험 결과를 바탕으로 유럽 임상시험계획서 작성을 시작했다. 오피스는 이날 유럽 임상국가를 폴란드로 확정했다는 설명이다.
대상 국가는 오피스가 보유하고 있는 유럽의 임상 데이터베이스를 근거로 선정됐다. 유럽 각국의 환자발생 추이, 정부 부처의 승인기준과 소요기간, 임상시험 기반 병원, 임상시험 책임자들의 시험참여 성향 등을 고려해 성공확률이 높고 진행속도가 빠른 국가를 골랐다는 것이다.
폴란드는 유럽에서 임상시험 관련 인허가가 빠르게 이뤄지는 국가들 중 하나다. 코로나19 치료제 임상 승인과 진행에 있어 가장 유리하다는 판단이다. 또 현재 오피스가 상주하며 여러 신약 임상시험을 진행하고 있어, 예상치 못한 지연이나 심각한 문제가 없을 것으로 보고 있다. 유럽 임상시험계획서 작성 작업도 마무리 단계에 있다.
조대웅 셀리버리 대표는 "미국 코방스에서 확보한 코로나19 치료효능 및 안전성평가 결과와 미국 임상시놉시스를 오피스에 전달했다"며 "유럽 임상시놉시스가 확정되면 자세한 임상프로토콜을 공개할 것"이라고 말했다. 이어 "유럽은 미국과 달리 사전협의제도(pre-IND meeting)를 거치지 않고 바로 임상 신청을 진행할 것"이라며 "임상 진입시기도 미국보다 빠를 수 있다"고 했다.
유럽 임상은 1상부터 코로나19 감염자와 비감염자를 대상으로 진행할 예정이다. 이에 따라 안전성과 유효성을 조기에 증명할 수 있을 것으로 기대하고 있다. 임상 2상부터는 미국과 유럽, 인도로 임상개발을 확대할 계획이다. 이는 향후 미국 식품의약국(FDA)의 긴급승인제도 및 유럽의약품청(EMA)의 동정적사용프로그램 허가를 받는 데 유리할 것이란 판단이다.
한민수 기자
-
기사 스크랩
-
공유
-
프린트





![기업실적 호조에 일제히 상승…테슬라는 최대폭 매출 감소[뉴욕증시 브리핑]](https://timg.hankyung.com/t/560x0/photo/202404/ZA.36457219.1.jpg)


![[단독]하이브 키운 '멀티 레이블'이 제 발등 찍었다](https://timg.hankyung.com/t/560x0/photo/202404/02.33877838.1.jpg)




