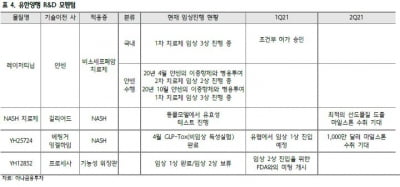
GC녹십자, 면역결핍치료제 IGIV 10% FDA 판매허가 신청
GC녹십자는 지난해 GC5107의 북미 임상 3상을 마무리했다. 일차 면역결핍증 환자를 대상으로 한 임상에서 FDA 지침에 준한 유효성 및 안전성 평가 변수를 만족시켰다.
유효성 측면에서 GC5107을 투약해 12개월 간 급성 및 중증 세균성 감염 빈도를 측정했다. FDA 기준인 1보다 낮은 0.02의 수치를 나타냈다. 안전성 평가에서도 약물로 인한 사망이나 심각한 수준의 이상반응이 관찰되지 않았다.
미국 면역글로불린 시장은 81억 달러 규모를 형성하고 있다. 최근 자가면역질환의 증가로 면역글로불린에 대한 수요는 증가하는 추세란 설명이다. 미국은 세계에서 가장 큰 면역글로불린 시장이며, 면역글로불린의 미국 시장 가격은 국내보다 4배 정도 높게 형성돼 있다고 회사 측은 전했다.
허은철 GC녹십자 사장은 "이번 신청은 대한민국 바이오 의약품 사업의 미국 시장 진출이라는 목표를 향한 큰 도약을 의미한다"며 "세계 시장에서 인정받은 제품력을 기반으로 미국 내 의료진과 환자들에게 의미 있는 치료법을 제공할 예정"이라고 말했다.
바이오 의약품의 FDA 품목허가 절차는 일반적으로 60일 간의 예비심사를 통해 제출된 자료의 수용 여부가 검토된다. 이후 통상 10개월 내 품목허가 승인 여부가 결정된다.
한민수 기자 hms@hankyung.com
-
기사 스크랩
-
공유
-
프린트


![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)


![[단독] "경영보다 돈"…아워홈 매각 손잡은 남매](https://timg.hankyung.com/t/560x0/photo/202404/AA.36472890.1.jpg)





