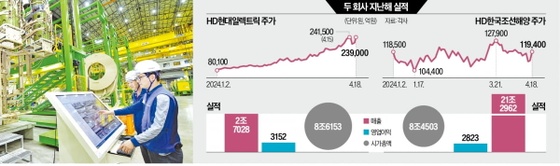
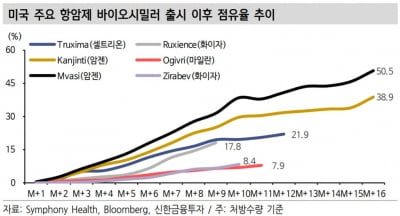
코아스템, 루게릭병 줄기세포치료제 美 응급 임상 승인
내년 1월 배송 예정
코아스템에 따르면 이번 응급 임상 승인은 지난 7월 코아스템이 FDA로부터 승인받아 국내에서 진행하는 임상 3상과는 별개의 임상이다. 미국 MGH(이하 하버드부속병원)가 미국 내 뉴로나타-알의 치료를 희망하는 루게릭병 환자의 치료목적으로 이 치료제의 생산 및 공급을 제안해 이번 응급임상 승인을 진행했다는 설명이다.
응급임상 승인에 따라 코아스템은 뉴로나타-알을 국내에서 생산해 미국으로 배송할 예정이다. 시술은 하버드 부속 병원에서 진행한다.
코아스템은 내년 1월 중 첫 치료제가 미국으로 배송될 것으로 예상하고 있다. 회사는 이번 응급임상을 계기로 미국 내 다수의 종합병원과의 공동임상 및 연구 네트워크를 만들어 나갈 계획이다.
코아스템은 뉴로나타-알에 냉장 보존제를 적용하는 시험을 완료하고, 내년 초 식약처에 변경 승인을 신청할 예정이다. 국내 상업 판매분에 대해 우선 적용한다는 계획이다. 냉장 보존제를 적용할 경우 뉴로나타-알의 보관 기간은 현재 2일에서 7일로 늘어나게 된다.
김경숙 코아스템 대표는 “이번 FDA 응급임상 승인은 신종 코로나바이러스 감염증(코로나19)으로 외국 환자들이 국내로 방문해 치료받는 것이 현실적으로 불가능한 상황에서, 미국 내 환자들의 요청을 받은 하버드 부속병원의 제안에 따라 이뤄지게 됐다”며 “FDA의 임상 3상에 대한 신뢰 수준을 한층 높일 수 있을 것”이라고 말했다.
김예나 기자 yena@hankyung.com
-
기사 스크랩
-
공유
-
프린트
![[한경 팩트체크] SCM생명과학 급등…제2의 박셀바이오?](https://img.hankyung.com/photo/202011/01.24539271.3.jpg)


![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)