메지온, 두마리 토끼 사냥 성공할까
1680억원짜리 바우처 'PRV'
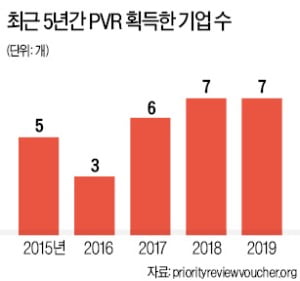
PRV를 처음 받은 곳은 2009년 말라리아 치료제를 개발한 다국적제약사 노바티스다. 지금까지 PRV를 받은 회사는 총 32곳이다. 올 들어서는 노보 노디스크, 사노피, 노바티스, 베르텍스 등 일곱 곳이 수령했다. 국내 제약·바이오기업 가운데 PRV를 받은 곳은 아직 한 곳도 없다.
PRV를 받으려면 FDA 허가를 받은 치료제 효과가 매우 뛰어나거나 적절한 치료법이 없는 질환을 치료하는 등 우선심사 대상이어야 한다. 유효기간 없이 언제든 사용할 수 있다. PRV를 사용할 때는 FDA에 245만달러(약 29억원)의 수수료를 지불해야 한다. 일반적인 의약품 심사 수수료보다 5~6배 많다.
PRV는 매매도 가능하다. 바이오벤처가 희귀질환 치료제를 개발해 획득한 PRV를 대형 제약사에 웃돈을 받고 팔 수 있다. 거래가격은 평균 1억4000만달러(1678억원) 정도다. PRV를 통해 판매 허가 시기를 앞당기면 경쟁사보다 시장 진입이 빨라지고 특허 유효기간까지 늘릴 수 있어 다국적제약사들의 수요가 크다.
사노피는 2015년 5월 레트로핀으로부터 2억4500만달러에 PRV를 사들였고 애브비는 같은 해 8월 유나이티드 테라퓨틱스로부터 3억5000만달러에 PRV를 구매했다.
메지온은 유데나필에 대한 임상 3상 결과를 오는 11월 미국심장학회에서 공개한 뒤 올해 안에 판매허가(NDA) 신청을 할 계획이다. 업계 관계자는 “유데나필은 패스트트랙에 지정된 약물”이라며 “패스트트랙의 80% 이상이 우선심사를 받았기 때문에 유데나필도 우선심사 대상이 될 가능성이 있다”고 말했다.
임유 기자 freeu@hankyung.com
-
기사 스크랩
-
공유
-
프린트











![[오늘의 arte] 독자 리뷰 : 당신의 미술 취향은 무엇인가요](https://timg.hankyung.com/t/560x0/photo/202404/AA.36523699.3.jpg)