EU, 한국 의약품 서류심사 면제…수출 쉬워진다
수출기간 최소 4개월 단축
러시아·동남아 시장확대 기대
식품의약품안전처는 14일(현지시간) 벨기에 브뤼셀에서 열린 EU 이사회에서 우리나라가 일곱 번째 EU 화이트 리스트에 등재됐다고 밝혔다. EU 화이트 리스트에 포함되면 제조 및 품질관리기준(GMP) 서면확인서를 면제받을 수 있다. EU는 원료의약품 불법 유통을 차단하기 위해 2013년 7월부터 제조원에 대한 수출국 정부의 인증서를 첨부하도록 의무화하는 서면확인서 제도를 시행하고 있다.
국내 제약사가 유럽에 수출하려면 식품의약품안전처의 실태 조사를 받은 뒤 EU GMP와 동등한 수준이라는 것을 입증하는 인증서를 제출해야 한다. 이 서류를 받으려면 최소 120일의 검토 기간이 필요하고 준비 작업까지 감안하면 1년가량 걸린다.
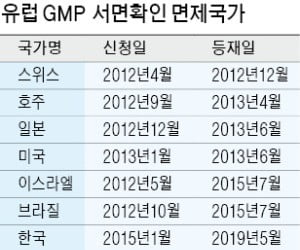
식약처는 우리나라 제약산업의 신인도가 높아지고 국내 제약산업의 수출 경쟁력 강화로 이어질 것으로 기대하고 있다. 화이트 리스트 등재 국가는 스위스 호주 일본 미국 이스라엘 브라질 등 총 6개국이다. 이 중 EU와 상호협약을 맺지 않고 직접 GMP 실사를 통해 등재받은 국가는 브라질과 한국뿐이다. 김영옥 식약처 의약품안전국장은 “국내 원료의약품 GMP 운영체계와 국내 제약사의 원료의약품 품질이 EU뿐 아니라 미국, 일본 등 제약 선진국과 동등한 수준임을 세계적으로 인정받은 것”이라고 평가했다.
국내 원료의약품의 유럽 수출도 활성화될 것으로 기대된다. 장기적으로 제네릭(복제약) 시장 규모가 큰 러시아 등 독립국가연합(CIS)이나 최근 의약품 분야 국가 간 협력이 강화되고 있는 베트남 등 아세안 시장 진출도 활발해질 전망이다. 유럽은 미국 다음으로 의약품 시장 규모가 큰 세계 2위 시장으로 국내 의약품 수출의 31%를 차지하고 있다. EU는 의료보험 재정 절감을 위해 제네릭을 확대하고 있다.
국내 제약산업에서 높은 비중을 차지하는 제네릭 원료의약품 생산 업체에 수출 확대의 호재가 될 것으로 보인다. 식약처는 “이번 화이트 리스트 등재는 국내 제약사의 글로벌 시장 진출의 기폭제가 될 것”이라며 “의약품 수출을 위해 국가 간 협력을 강화하고 각종 국제 협의체 활동에 적극적으로 참여하겠다”고 말했다.
전예진 기자 ace@hankyung.com
-
기사 스크랩
-
공유
-
프린트

![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)


![[단독] "경영보다 돈"…아워홈 매각 손잡은 남매](https://timg.hankyung.com/t/560x0/photo/202404/AA.36472890.1.jpg)





