지트리비앤티, 안구건조증 2차 임상 3상 완료…기술수출 일정은?
12일 지트리비앤티에 따르면 이 회사의 미국 합작사 리젠트리는 올 7월 안구건조증 치료제 후보물질 'RGN-259'의 2차 임상 3상(ARISE II) 환자 투여를 완료하고 최종보고서 수령을 앞두고 있다. 회사 측은 'RGN-259'는 ARISE II에서 1차 임상 3상(ARISE I)의 결과를 재현하고, 기존 치료제 대비 우월한 효과를 보인 것으로 주요 임상결과에서 확인됐다고 설명했다.
FDA는 안구건조증 치료제의 경우 2회 이상의 3상을 통해 약효의 재현을 요구하고 있다고 회사 측은 전했다. 지난해 8월 샤이어가 출시한 안구건조증 치료제 '자이드라'는 4번의 임상 3상을 진행했다.
자이드라는 각 3상마다 환자 선정 기준 및 평가변수가 달랐다. 그러나 지트리비앤티는 RGN-259의 1차와 2차 3상이 동일한 구조로 진행된 만큼 더 이상의 3상이 필요하지 않을 것으로 기대하고 있다. 우수한 임상 결과 확보로 기술수출 협상에 있어서도 유리한 위치를 잡게 됐다는 게 회사 측 판단이다.
지트리비앤티 관계자는 "RGN-259는 내년 1분기 FDA와의 회의 이후 약 6개월의 장기 안전성 평가를 거쳐 신약 허가를 신청할 수 있을 것으로 보고 있다"며 "내년 상반기 기술수출 계약 체결을 기대하고 있다"고 말했다.
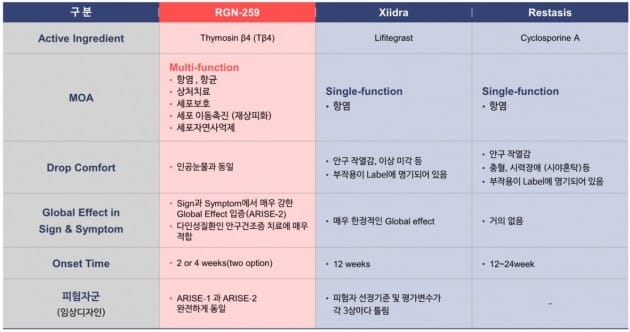
반면 RGN-259는 항염은 물론 상처 치료, 세포 보호, 세포자연사 억제 등 다양한 작용을 하기 때문에 기존 제품보다 많은 안구건조증 환자에게 효과를 보일 것으로 기대하고 있다. 또 1차 3상에서는 4주, 2차에서는 2주 만에 완치 효과가 나타나 12주 이상 사용해야 하는 기존 약보다 빠른 치료 속도를 보였다.
지트리비앤티는 과거 사례를 고려해 RGN-259의 기술수출 규모가 클 것으로 기대 중이다.
앨러간은 2015년 11월 미메토겐 파마슈티컬스의 임상 3상 중인 안구건조증 치료제를 초기 기술료 5000만달러(약 550억원)에 인수했다. 임상 3상 성공 및 신약 허가에 따른 성과 기술료(마일스톤)는 미공개다.
샤이어는 2013년 자이드라 3상에 들어가 있는 사코드 바이오사이언스를 계약금 1억6000만달러(약 1700억원)에 인수했다. 또 사코드 바이오사이언스 주주들에게 추가 마일스톤을 지급키로 했다. 업계에서는 초기 기술료를 감안해 이들의 전체 기술수출료가 6000억~1조원 안팎일 것으로 추정하고 있다.
RGN-259의 북미 판권은 미국 자회사 리젠트리가 가지고 있다. 리젠트리는 지트리비앤티와 미국 신약개발기업 리젠알엑스의 합작사다. 지트리비앤티의 보유 지분은 58%다. 지트리비앤티는 RGN-259의 신약 허가 시 리젠트리 지분을 75%까지 확대할 수 있는 권리를 가지고 있다.
한민수 기자 hms@hankyung.com
-
기사 스크랩
-
공유
-
프린트












![MBC '뉴스데스크' 앵커 출신 박혜진, 파격 근황 봤더니 [이일내일]](https://timg.hankyung.com/t/560x0/photo/202404/01.36513659.3.jpg)