제넥신, 지속형 성장호르몬 2상 성공적…기술수출 가능성↑
제넥신은 지난 16일(현지시간) 미국 워싱턴에서 열린 제10회 국제소아내분비학회(IMPE)에서 한독과 공동 개발 중인 지속형 성장호르몬 'GX-H9'의 소아 대상 유럽·한국 임상2상의 중간 결과를 발표했다고 18일 밝혔다.
양사는 2상을 통해 GX-H9의 주 1회 또는 2주 1회 제형으로의 가능성을 확인할 계획이다. 현재 성장호르몬 결핍증에 쓰이는 성장호르몬은 하루에 한 번 투여해야 하는 1일 제형이다. 평균 2년 이상의 치료기간 동안 매일 맞아야 한다는 불편함 때문에, 매일 투약하지 않은 환자가 많이 발생하는 상황이다. 이로 인해 치료 효과도 떨어지게 돼 지속형 성장호르몬의 필요성이 커지고 있는 것이다.
GX-H9 2상의 목표는 주 1회 또는 2주 1회에서 1일 제형 이상의 안전성과 효능의 확보다. 이번에 발표된 중간 결과를 보면 9부 능선을 넘었다.
계획한 48명의 환자 중 90%인 43명의 6개월 투여 결과, GX-H9는 1일 제형인 '지노트로핀'보다 높은 키 성장률을 보였다.
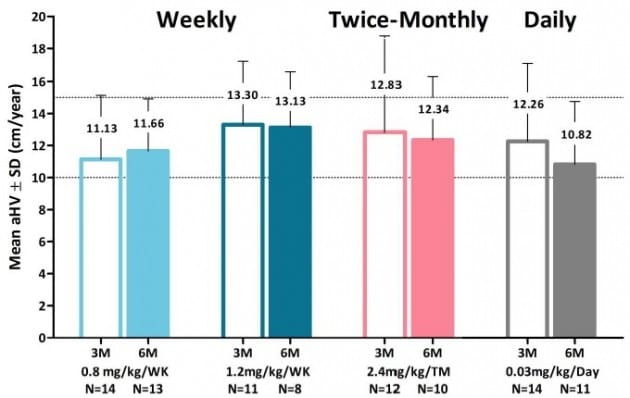
이는 2014년 옵코가 다국적 제약사 화이자에 5000억원 규모의 기술수출을 성사시켰을 때와 비슷한 수치다. 이 계약은 옵코가 임상2상에서 목표한 6개월 키 성장률을 달성한 이후 이뤄졌다.
GX-H9은 안전성에 있어서도 좋은 결과를 보여줬다. 심각한 부작용이 발견되지 않았고, 변형된 단백질 투약에서 가장 우려되는 부작용 중 하나인 중화항체(ADA) 형성은 관찰한 40명 중 2.5%인 1명에서만 나타났다.
선민정 하나금융투자 연구원은 "이번 결과로 GX-H9는 임상2상의 1차 목표를 거의 달성했다고 볼수 있다"며 "기술이전도 기대해 볼만하다"고 말했다.
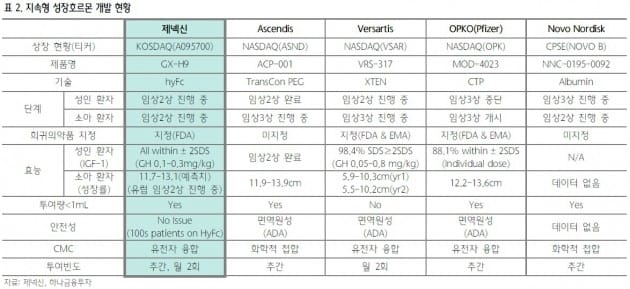
또 주1회는 물론 2주1회 제형의 효과도 입증한 만큼, GX-H9의 가치는 더 크다고 판단했다. 옵코의 지속형 성장호르몬은 주1회 제형이다.
-
기사 스크랩
-
공유
-
프린트










!['베니스의 장인들' 르네상스 조선소에 쿵쿵쿵 망치질! 클래스가 달랐던 토즈 전시 [2024 베네치아 비엔날레]](https://timg.hankyung.com/t/560x0/photo/202404/01.36496137.3.jpg)