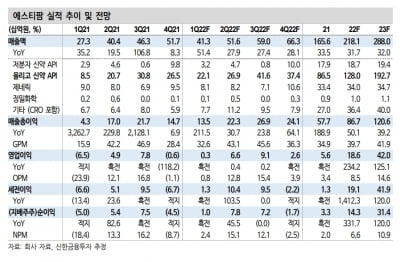
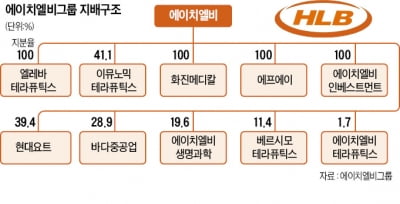
브릿지바이오, AACR서 4세대 폐암치료제 연구 포스터 발표
연내 FDA IND 제출 목표

BBT-207은 브릿지바이오테라퓨틱스가 자체 발굴한 물질이다. 비소세포폐암 환자에게서 ‘오시머티닙’(제품명 타그리소) 등 3세대 ‘EGFR’ 저해제 치료 후 내성으로 나타나는 ‘C797S’ 양성 이중 돌연변이를 표적 치료하는 신규 ‘상피세포 성장인자 수용체 티로신 인산화효소 억제제(EGFR TKI)’로 개발 중이다.
회사는 12일(현지시간) 포스터 세션을 통해 세포 및 동물실험 기반 BBT-207의 C797S 양성 이중 돌연변이 저해능 및 동물 모델에서의 약동학적 평가 결과 등을 공개했다. 향후 개발 전략도 소개했다.
세포 기반 약물 효능 평가 결과에 따르면, BBT-207은 C797S 돌연변이를 포함해 이중 돌연변이인 ‘DC(Del19·C797S)’ 또는 ‘LC(L858R·C797S)’를 억제하는 효능이 기존 약제 대비 경쟁력 있게 나타났다는 게 회사의 설명이다.
체외(in-vitro) 실험을 통해 EGFR 인산화 활성을 절반 수준으로 낮추는 데 필요한 약물 농도를 보는 ‘IC50’ 값도 확인했다. 그 결과 C797S 및 DC·LC 이중변이에 대해 오시머티닙의 IC50 값은 각각 304.4나노몰(nM), 573.7nM로 나타난 반면, BBT-207은 모두 0.8nM로 나타났다. 상대적으로 적은 농도로 이들 변이에 저해능을 보였다는 설명이다. 이러한 EGFR 인산화 활성 저해능은 EGFR 활성변이를 발현하는 ‘Ba’와 ‘F3’ 세포주 대상 실험에서도 기존 치료제 대비 경쟁력을 확인했다고 했다.
C797S를 포함한 이중 돌연변이(LC)가 유도된 동물 모델에서 약물 반응 지속 기간을 관찰한 결과에서는 BBT-207이 용량 비례적으로 항종양 효능을 나타냈다. 최대 40mg/kg으로 BBT-207을 1일 1회 경구 투약한 경우, 2주 이상 항종양 효능이 이어졌다. 또 고용량 투약 시 ‘T790M’ 양성 이중 돌연변이 ‘DT(Del19·T790M)’ 및 ‘LT(L858R·T790M)’를 비롯해 암 유발 원인 돌연변이 2종(Del19·L858R)에서 오시머티닙 대비 높은 항종양 효능을 보였다. 이를 통해 비소세포폐암의 초기 치료제로 개발이 가능할 것으로 회사는 보고 있다.
동물 모델에서의 BBT-207의 약동학적 평가도 공개됐다. 개와 원숭이 등 동물 모델에서 BBT-207 단회 투약 후 혈중 약물 농도의 흐름을 확인한 결과, 24시간 이상 IC50 이상의 혈중 약물 노출이 유지돼 BBT-207의 1일 1회 복용에 대한 약동학적 근거를 확보했다.
회사 관계자는 “미충족 의료 수요에 대응하기 위해 지난해 11월 BBT-207을 자체 발굴 후보물질로 선정하고 개발에 매진 중”이라며 “연내 미국 식품의약국(FDA)에 BBT-207의 임상시험계획(IND)을 제출하고 내년 환자 대상 임상에 진입하는 게 목표”라고 말했다.
브릿지바이오테라퓨틱스의 발굴생물학 총괄 담당인 지미 진 부사장은 “현재 세계적으로 이중 돌연변이 등 다양한 내성에 대응하는 신규 비소세포폐암 치료제 수요가 높아지고 있다”며 “‘BBT-176’과는 차별화된 BBT-207의 약물 효능 정보(프로파일)를 바탕으로 내성 돌연변이를 억제하는 효과적인 비소세포폐암 치료법을 조기에 제공하도록 노력할 것”이라고 말했다.
현재 타그리소 내성 치료제 개발을 놓고 브릿지바이오와 미국 블루프린트가 경쟁 중이다. 이번 AACR에서 블루프린트의 후보물질인 ‘BLU-945’의 임상 1·2상 결과도 공개됐다. 시험 결과 1명의 환자에게서 ‘미확정 부분반응(uncomfirmed PR)’이 관찰됐다. 4~5등급의 심각한 부작용은 보고되지 않았다.
임상 시작 시기는 브릿지바이오보다 늦었지만 인체 대상 임상 발표는 블루프린트가 앞섰다. 이에 대해 허혜민 키움증권 연구원은 “브릿지바이오 임상이 국내로 한정돼있던 것에 비해 블루프린트는 다국가 임상을 진행했기 때문에 환자 모집이 더욱 잘 됐을 것으로 보인다”고 분석했다.
그러나 경쟁사가 좋은 결과로 이목을 집중시켰다는 점이 브릿지바이오의 사업개발에도 긍정적으로 작용할 것이란 판단이다. 허 연구원은 “AACR 월요일 발표에서 ‘스타’ 기업으로 어피메드와 블루프린트가 거론됐다”며 “3세대 EGFR TKI 치료제로 경쟁 중인 존슨앤드존슨 및 폐암 치료제 경쟁사들이 브릿지바이오 등 블루프린트 경쟁사와의 협력(파트너십)이 필요할 것으로 보인다”고 했다.
이도희 기자
-
기사 스크랩
-
공유
-
프린트


![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)


![[단독] "경영보다 돈"…아워홈 매각 손잡은 남매](https://timg.hankyung.com/t/560x0/photo/202404/AA.36472890.1.jpg)





