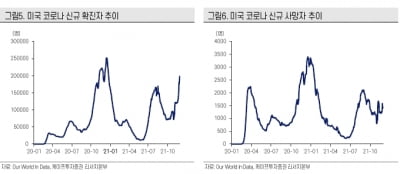
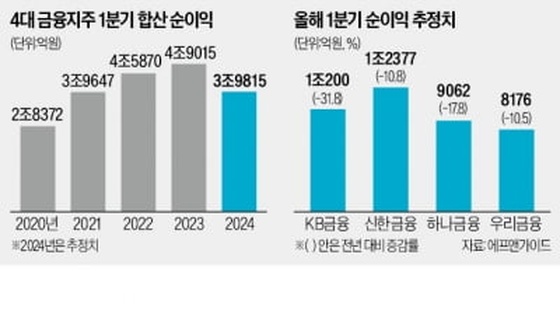
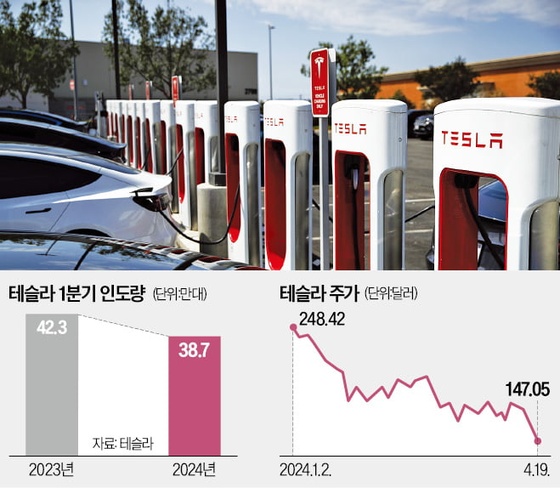
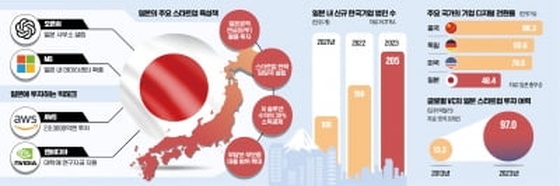
휴온스바이오파마, 보툴리눔 톡신 미간주름 임상 2상 승인
이번 2상에서는 중등증 또는 중증의 미간주름이 확인된 성인을 대상으로 대조약 비교 평가를 진행한다. 이를 통해 미간주름 개선 효과 및 안전성을 입증한다는 계획이다.
휴온스바이오파마는 지난해 12월 1상을 통해 HU-045주에 대한 미간주름 개선 효과 및 안전성과 내약성을 확인했다. HU-045주의 첫 적응증 획득 시점은 2023년으로 예상하고 있다.
HU-045주는 비독소 단백질을 제거하고 효능을 나타내는 150kDa(킬로달톤) 크기의 신경독소만을 정제해 개발됐다. 면역 항체 형성 가능성을 낮춰 내성 발생 가능성을 줄였다는 설명이다.
회사 관계자는 “보툴리눔 톡신 제제 특성상 주기적으로 시술을 받는 경우가 많아 투여기간 및 횟수, 용량 등에 따라 내성이 발생할 수 있다”며 “HU-045주와 같이 내성 발현을 줄인 보툴리눔 톡신 제제에 대한 관심이 높아지고 있다”고 말했다.
김영목 휴온스바이오파마 대표는 “임상 1상을 통해 HU-045주의 효과와 안전성을 충분히 확인한 만큼 임상 2상도 성공적으로 마무리될 것으로 기대한다”며 “HU-045주는 ‘리즈톡스’와 같이 휴온스바이오파마의 핵심 품목으로 성장해 보툴리눔 톡신 사업 성장을 주도할 핵심 품목이 될 것”이라고 했다.
이도희 기자
-
기사 스크랩
-
공유
-
프린트