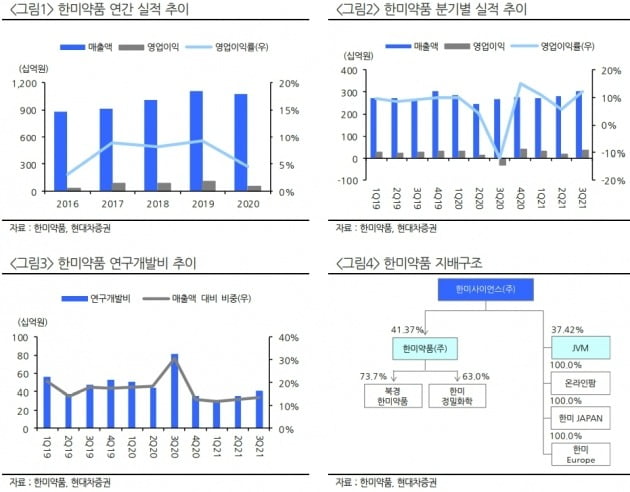
“한미약품, 다양한 임상 순항 중…포지오티닙 美 출시 주목”
연말 ‘포지오티닙’ 관련 동력(모멘텀)에 주목하라고 했다. 공동 개발 중인 미국 스펙트럼은 연내 미국 식품의약국(FDA)에 포지오티닙의 신약시판허가(NDA)를 신청할 예정이다.
엄민용 연구원은 “포지오티닙이 연초 FDA 신속심사(패스트트랙) 대상으로 지정된 만큼 심사 기간이 6개월까지 단축될 예정”이라며 “내년 중순에는 허가가 가능할 것”이라고 전망했다.
앱토즈로 기술수출한 ‘HM43239’는 ‘FLT3·SKT’ 저해제다. 한미약품은 지난해 미국혈액학회(ASH)에서 기존 표적항암제에 내성을 가진 급성골수성백혈병 환자 대상 미국 임상 1·2상 중간결과, 17.9%에서 완전관해(CR)가 관찰됐다고 발표했다.
HM43239는 4800억원 규모로 기술이전됐다. 현재 급성골수성백혈병(AML) 미국 임상 1·2a상이 진행 중이다. 계약금은 148억원이다. 현금 500만달러(약 60억원)와 약 750만달러(약 90억원)의 앱토즈 주식을 수령하는 구조다. 올 4분기부터 매출로 부분 인식될 것이란 예상이다.
한미약품이 미국 랩트로부터 이전받은 ‘FLX475’의 임상 결과는 지난 17일 열린 면역항암학회(SITC)에서 발표됐다. 세계 최초 ‘CCR4’ 표적 종양 미세환경(TME) 조절제다.
FLX475와 ‘키트루다’ 병용 위암 환자 대상 국내 임상 2상에서, 6주기 차에 간에 전이된 종양의 크기가 58% 감소하는 부분 반응(PR)이 확인됐다.
제넨텍·로슈로 기술이전된 ‘벨바라페닙’은 'MEK' 저해제 코비메티닙과의 병용 임상이 진행 중이다.
지속형 호중구감소증 치료제 롤론티스의 발매 시기는 빨라도 내년 하반기로 전망했다. 한미약품은 지난 8월 FDA로부터 롤론티스 생산 관련 재실사를 위한 보완요구서한(CRL)을 수령했다.
-
기사 스크랩
-
공유
-
프린트












!['베니스의 장인들' 르네상스 조선소에 쿵쿵쿵 망치질! 클래스가 달랐던 토즈 전시 [2024 베네치아 비엔날레]](https://timg.hankyung.com/t/560x0/photo/202404/01.36496137.3.jpg)