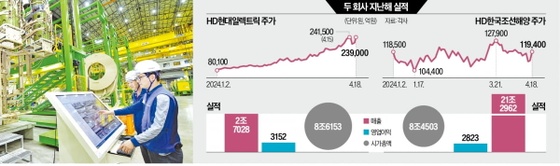
바이오랜드, 창상피복재 식약청 제조품목 허가
이번에 허가받은 소 양막 유래 창상피복재(Amnisite-BA-1외 3종)는 2007년 8월부터 약 10개월간 2도 화상환자를 대상으로 한강성심병원 화상센터와 대구동산병원에서 다기관 임상시험을 진행했으며 제품의 안전성과 효과를 식약청으로부터 인정받아 제조품목허가를 받게 됐다.
이 제품은 기존의 다른 창상피복재와는 달리 상처가 치유되기까지 단 일회만 적용해 상처가 치유되면서 자연스럽게 상처로부터 분리되는 제품으로, 기존의 처치 방법에 비해 빠른 상처 치유 효과를 보였다는 게 회사측 설명이다. 특히 치유기간 중 창상피복재를 교체할 필요가 없어 환자들의 고통 해소에 많은 도움을 줄 수 있을 것으로 기대되고 있다.
회사측에 따르면 양막에는 상처 치유에 도움이 되는 다양한 상처 치유 인자들을 함유하고 있는 것으로 보고돼 왔다. 바이오랜드는 2004년 대동물 실험을 통해 상처치유 효과를 확인한 바 있으며 생물학적 안전성에 관한 시험 결과를 토대로 2008년에 미국 식품의약국(FDA)에 이미 허가서를 제출한 상태이다.
회사 관계자는 "이번에 허가받은 소양막 유래 창상피복재는 기존의 합성 고분자를 원료로하는 창상피복재와는 다른 차원의 제품"이라며 "이미 허가받은 콜라겐 창상피복재와 더불어 약 500억원 정도로 추산되는 국내 상처 치유 시장과 약 7736만 달로로 추정되는 해외 콜라겐 창상피복재 시장에서 점유를 늘려갈 계획"이라고 말했다.
이 관계자는 "기존에 허가받은 각막이식재(조직은행), 멤브레인(치과용)과 함께 금년 하반기부터 본격적인 판매가 이루어져 매출증대에 크게 기여할 것으로 본다"고 덧붙였다.
한경닷컴 정형석 기자 chs8790@hankyung.com
-
기사 스크랩
-
공유
-
프린트


![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)