혈류 타는 '전이암 씨앗'도 마이크로칩으로 걸러낸다
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
전이 위험 큰 '순환 종양 세포' 클러스터 여과 기술 개발
간단한 혈액 검사로 전이 경로ㆍ진행 단계 등 확인 가능
미국 조지아 공대 연구진, '네이처 커뮤니케이션'에 논문
원발 암에서 떨어져 혈액의 흐름을 타고 다른 기관으로 이동하는 암세포를 '순환 종양 세포'(CTCs)라고 한다.
CTCs는 암을 퍼뜨리는 전이암의 씨앗 같은 존재다.
과거엔 CTCs를 추적해 분리하는 게 거의 불가능하다고 여겼다.
혈액 내의 CTCs가 워낙 드문데다 분리 과정에서 파괴될 위험도 크기 때문이다.
마침내 미국 조지아 공대 과학자들이 CTCs를 탐지해 안전하게 분리하는 기술을 개발했다.
암이 어떤 경로를 통해 전이하고, 어느 정도 진행됐는지 정확히 알 수 있는 이 기술은 암 치료에 혁명적 변화를 가져올 수도 있다고 과학자들은 말한다.
간단한 혈액 검사로 전이암을 찾아낸 뒤 구체적인 목표를 정해 조기에 치료를 시작할 수 있다는 것이다.
조지아 공대(약칭 조지아텍) 전기 컴퓨터 공학 대학의 파티흐 사리오글루 부교수팀이 수행한 이 연구 결과는 최근 저널 '네이처 커뮤니케이션'(Nature Communications)에 논문으로 실렸다.
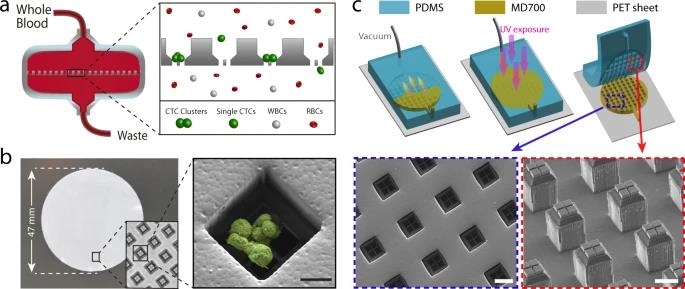
17일 미국 과학진흥협회(AAAS) 사이트(www.eurekalert.org)에 공개된 논문 개요 등에 따르면 원발 암에서 떨어진 암세포는 클러스터(clusterㆍ군집)를 형성해야 다른 기관에 전이할 확률이 높아진다.
하나하나의 CTCs는 흐르는 혈액의 거친 환경에서 자력으로 살아남기 어렵다.
하지만 CTCs가 클러스터를 형성하면 훨씬 더 강건해져 효율적인 '전이 모드' 전환이 가능하다.
CTCs 클러스터는 혈류에 실려 떠다니는 '미세 색전'(circulating tumor microemboli)처럼 여러 개의 CTCs가 뭉친 걸 말한다.
문제는 CTCs 클러스터가 매우 드물다는 것이다.
CTCs만 해도 혈액 1㎖당 적게는 1개, 많게는 10개가량 존재한다.
인간의 혈액엔 1㎖당 수십억 개의 세포가 있는데 전이암 환자라 해도 CTCs를 찾는 건 극히 어렵다.
게다가 CTCs 가운데 클러스터를 형성하는 건 2∼5%에 불과하다.
CTCs의 생성률과 반감기(혈액 내 생존 기간)도 암의 유형에 따라 크게 다르다.
미국 MIT(매사추세츠공대)의 스콧 마닐라스 생물공학과 석좌교수팀이 이에 관한 연구 결과를 발표한 바 있다.
(2021년 9월 '네이처 커뮤니케이션' 논문 참조)
생쥐의 몸 안에 생긴 췌장암, 소세포폐암, 비소세포폐암 등 3개 유형의 암 종양에 실험했더니 CTCs의 반감기는 짧은 게 40초, 긴 게 250초로 나왔다.
또 공격적으로 전이하는 소세포 폐암은 1시간당 10만여 개의 CTCs가 원발 암에서 이탈했지만, 비 소세포 폐암과 췌장암은 각각 약 60개에 불과했다.
사리오글루 교수팀은 기존의 여과 기술을 쓸 수 없었다.
여과하는 힘이 너무 강해 거르는 과정에서 CTCs 클러스터가 해체됐기 때문이다.
그래서 '클러스터 웰'(Cluster-Well)이라는 완전히 새로운 유형의 마이크로칩을 개발했다.
겉만 보면 표준적인 박막 필터와 비슷한 이 칩은 매우 섬세한 구조를 갖췄다.
미세유동 칩의 정밀함에다 막(膜) 여과 효율성까지 높아 CTCs 클러스터만 정확히 걸러낼 수 있다고 한다.
이 칩은 또 혈액 샘플의 수많은 세포 중에서 어느 게 암세포인지 식별하는 성능도 갖췄다.
처음엔 컴퓨터 CPU와 같은 실리콘으로 만들었다가 접근성 등을 높이기 위해 중합체 재질로 바꿨다.

연구팀은 난소암과 전립선암 환자의 혈액 샘플에 '클러스터 웰'을 테스트했다.
결과는 성공적이었다.
1인당 적게는 2개부터 많게는 100개 이상의 CTCs 클러스터를 분리했다.
난소암 환자의 혈액에서 분리한 클러스터엔 수백 개의 CTCs가 살아 있는 상태로 관찰됐다.
클러스터가 암의 전이 가능성을 높인다는 걸 다시 확인할 수 있었다.
전립선암 환자의 CTCs 클러스터에 대해 RNA 시퀀싱(염기서열 분석)을 해 보니, 환자에 따라 발현하는 유전자가 달랐다.
이는 개인 맞춤형 표적 치료에 적용될 잠재력이 크다는 걸 시사한다.
연구팀은 '클러스터 웰' 검사가 암 치료 과정의 일상적인 절차가 될 거로 기대하고 있다.
사리오글루 교수는 "순환 종양 세포 클러스터는 포착하기조차 매우 어렵다"라면서 "하지만 우리 기술을 쓰면 지금까진 실현하기 어려웠던 정밀성과 실용성을 갖춰 어떤 암의 클러스터도 찾아낼 수 있다"라고 강조했다.
/연합뉴스
간단한 혈액 검사로 전이 경로ㆍ진행 단계 등 확인 가능
미국 조지아 공대 연구진, '네이처 커뮤니케이션'에 논문

CTCs는 암을 퍼뜨리는 전이암의 씨앗 같은 존재다.
과거엔 CTCs를 추적해 분리하는 게 거의 불가능하다고 여겼다.
혈액 내의 CTCs가 워낙 드문데다 분리 과정에서 파괴될 위험도 크기 때문이다.
마침내 미국 조지아 공대 과학자들이 CTCs를 탐지해 안전하게 분리하는 기술을 개발했다.
암이 어떤 경로를 통해 전이하고, 어느 정도 진행됐는지 정확히 알 수 있는 이 기술은 암 치료에 혁명적 변화를 가져올 수도 있다고 과학자들은 말한다.
간단한 혈액 검사로 전이암을 찾아낸 뒤 구체적인 목표를 정해 조기에 치료를 시작할 수 있다는 것이다.
조지아 공대(약칭 조지아텍) 전기 컴퓨터 공학 대학의 파티흐 사리오글루 부교수팀이 수행한 이 연구 결과는 최근 저널 '네이처 커뮤니케이션'(Nature Communications)에 논문으로 실렸다.

하나하나의 CTCs는 흐르는 혈액의 거친 환경에서 자력으로 살아남기 어렵다.
하지만 CTCs가 클러스터를 형성하면 훨씬 더 강건해져 효율적인 '전이 모드' 전환이 가능하다.
CTCs 클러스터는 혈류에 실려 떠다니는 '미세 색전'(circulating tumor microemboli)처럼 여러 개의 CTCs가 뭉친 걸 말한다.
문제는 CTCs 클러스터가 매우 드물다는 것이다.
CTCs만 해도 혈액 1㎖당 적게는 1개, 많게는 10개가량 존재한다.
인간의 혈액엔 1㎖당 수십억 개의 세포가 있는데 전이암 환자라 해도 CTCs를 찾는 건 극히 어렵다.
게다가 CTCs 가운데 클러스터를 형성하는 건 2∼5%에 불과하다.
CTCs의 생성률과 반감기(혈액 내 생존 기간)도 암의 유형에 따라 크게 다르다.
미국 MIT(매사추세츠공대)의 스콧 마닐라스 생물공학과 석좌교수팀이 이에 관한 연구 결과를 발표한 바 있다.
(2021년 9월 '네이처 커뮤니케이션' 논문 참조)
생쥐의 몸 안에 생긴 췌장암, 소세포폐암, 비소세포폐암 등 3개 유형의 암 종양에 실험했더니 CTCs의 반감기는 짧은 게 40초, 긴 게 250초로 나왔다.
또 공격적으로 전이하는 소세포 폐암은 1시간당 10만여 개의 CTCs가 원발 암에서 이탈했지만, 비 소세포 폐암과 췌장암은 각각 약 60개에 불과했다.
사리오글루 교수팀은 기존의 여과 기술을 쓸 수 없었다.
여과하는 힘이 너무 강해 거르는 과정에서 CTCs 클러스터가 해체됐기 때문이다.
그래서 '클러스터 웰'(Cluster-Well)이라는 완전히 새로운 유형의 마이크로칩을 개발했다.
겉만 보면 표준적인 박막 필터와 비슷한 이 칩은 매우 섬세한 구조를 갖췄다.
미세유동 칩의 정밀함에다 막(膜) 여과 효율성까지 높아 CTCs 클러스터만 정확히 걸러낼 수 있다고 한다.
이 칩은 또 혈액 샘플의 수많은 세포 중에서 어느 게 암세포인지 식별하는 성능도 갖췄다.
처음엔 컴퓨터 CPU와 같은 실리콘으로 만들었다가 접근성 등을 높이기 위해 중합체 재질로 바꿨다.

연구팀은 난소암과 전립선암 환자의 혈액 샘플에 '클러스터 웰'을 테스트했다.
결과는 성공적이었다.
1인당 적게는 2개부터 많게는 100개 이상의 CTCs 클러스터를 분리했다.
난소암 환자의 혈액에서 분리한 클러스터엔 수백 개의 CTCs가 살아 있는 상태로 관찰됐다.
클러스터가 암의 전이 가능성을 높인다는 걸 다시 확인할 수 있었다.
전립선암 환자의 CTCs 클러스터에 대해 RNA 시퀀싱(염기서열 분석)을 해 보니, 환자에 따라 발현하는 유전자가 달랐다.
이는 개인 맞춤형 표적 치료에 적용될 잠재력이 크다는 걸 시사한다.
연구팀은 '클러스터 웰' 검사가 암 치료 과정의 일상적인 절차가 될 거로 기대하고 있다.
사리오글루 교수는 "순환 종양 세포 클러스터는 포착하기조차 매우 어렵다"라면서 "하지만 우리 기술을 쓰면 지금까진 실현하기 어려웠던 정밀성과 실용성을 갖춰 어떤 암의 클러스터도 찾아낼 수 있다"라고 강조했다.
/연합뉴스


![[속보] 헌재 "수명재판관 2명 지정·헌법연구관 TF 구성할 것"](https://img.hankyung.com/photo/202412/02.22579247.3.jpg)

![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


