10일(현지시간) 이도르시아는 폭식 장애 치료제인 ‘ACT-539313’의 임상 2a상에서 1차 평가변수를 충족하지 못했다고 밝혔다.
이도르시아의 글로벌 임상개발 책임자인 알베르토 지모나 박사는 “ACT-539313은 임상 1상을 통해 고무적인 안전성 데이터를 얻었지만, 폭식 장애를 적응증으로 삼지는 않을 것”이라며 사실상 임상 실패를 선언했다.
이도르시아는 2a상에서 중증 폭식 장애 환자 136명을 무작위 배정한 뒤, 12주간 위약 혹은 ACT-539313 100mg을 하루 두 번 투여했다. 이후 한 주간 폭식을 한 횟수를 이전과 비교했다. 그 결과 ACT-539313은 위약과 유의미한 차이를 보이지 못했다.
이에 따라 회사는 홈페이지 내 후보물질 목록에 ACT-539313을 유지하고 있지만, 적응증을 ‘폭식 장애’에서 ‘평가 중’으로 변경한 상태다.
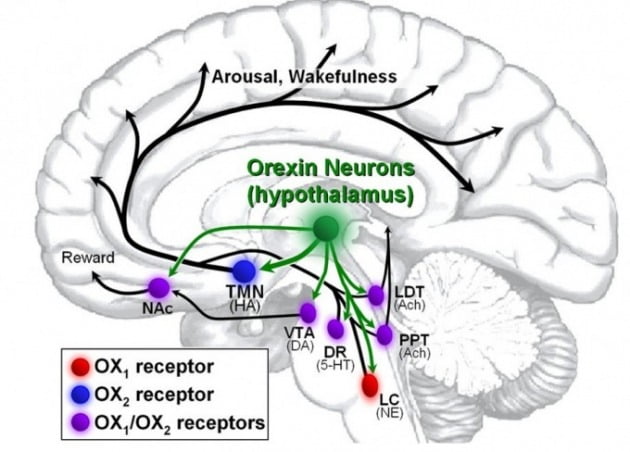
ACT-539313은 뇌에 존재하는 ‘오렉신1’ 수용체 저해제다. 오렉신은 뇌의 시상하부에서 분비되는 신경전달물질이다. 뇌세포의 오렉신 수용체에 결합하면 각성 식욕 등의 현상이 나타난다. 이도르시아는 이런 기전을 기반으로 불면증과 폭식 장애, 두 질환에 대한 약물을 개발해 왔다.
두 약물 모두 오렉신과 오렉신 수용체의 결합을 저해하는 기전을 가지고 있지만, 임상 결과는 정반대였다. 각성을 막고 수면을 유도하는 큐비빅(성분명 다리도렉산트)은 글로벌 임상 3상에서 수면 개시, 수면 유지, 수면 시간 등을 모두 개선시켰다. 당시 국내에서도 한독이 국내 임상을 맡아 50명의 환자가 임상에 참여했다.
임상 3상 결과를 토대로 큐비빅은 올 1월 미국 FDA의 승인을 받았다. 규제약물로 등록을 마치는 대로 시장에 진출할 예정이다.
오렉신 계열의 불면증 치료제로는 일본 에자이의 데이비고, 미국 머크(MSD)의 벨솜라에 이어 세 번째다. 현재 국내에서 승인받은 오렉신 계열 불면증 치료제는 없다.
큐비빅은 지난 3일 유럽 집행위원회에서도 허가를 받았다. 유럽에서는 불면증 증상이 최소 3개월 이상 나타나며, 평소 일과에 영향을 받는 성인 환자에 대해 판매를 시작할 계획이다.
ACT-539313의 임상 2상 실패로 이도르시아의 주가는 13.53스위스프랑(CHF)으로 한달 새 29% 급락했다.
최지원 기자 jwchoi@hankyung.com