바이오라드 장비에 씨젠 시약 탑재
씨젠은 미국 바이오라드와 분자진단 시약과 장비에 대해 미국 식품의약국(FDA) 공동 승인 및 유통 계약을 체결했다고 1일 밝혔다. 양사는 씨젠의 분자진단 시약을 바이오라드의 진단기기에 탑재해 FDA로부터 승인받기 위한 절차에 착수했다. 유통계약의 기간은 FDA로부터 승인을 받는 날부터 5년이다. 바이오라드가 씨젠의 시약의 팔게 된다.
작년 코트라(KOTRA)에서 발표한 '미국 체외진단기기 시장동향'에 따르면 북미는 세계 체외진단 시장의 약 37%를 차지한다. 그러나 미국은 글로벌 진단기기 업체가 선도적 입지를 구축하고 있고, 자국 제품을 우선시하는 정부 기조가 강해 시장 진입이 어려웠다는 설명이다. 바이오라드와의 계약은 미국 시장 진출에 획기적인 계기가 될 것으로 씨젠 측은 기대하고 있다.
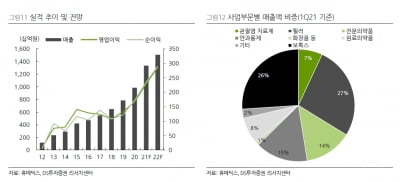
바이오라드는 지난 10년간 협력 관계를 구축해 온 씨젠의 핵심 협력사이기도 하다. 씨젠은 세계에 설치된 바이오라드의 진단장비 3900여대에 진단시약을 적용해 연간 1조원 이상의 매출을 올렸다.
씨젠이 FDA 승인을 추진할 진단시약에는 멀티플렉스(high multiplex) 진단기술이 적용됐다. 대용량 검사 시스템에서 여러 개의 표적 병원체를 동시에 검출해 낼 수 있는 세계 유일의 기술이라고 했다. 또 표적 병원체만을 선별적으로 동시 다중으로 증폭하는 기술, 병원체의 종류와 함께 정량까지 산출하는 기술 등 씨젠만의 특허 기술이 포함돼 있어 미국 시장에서 경쟁력을 갖출 것으로 보고 있다.
씨젠은 우선 코로나19 동시진단 키트인 'Allplex SARS-CoV-2/FluA/FluB/RSV Assay' 외 7개 전략 제품의 FDA 승인을 획득할 예정이다. 향후 매년 5개 이상 제품의 FDA 승인이 목표다. 미국 현지 생산 및 연구 시설을 구축하는 방안도 계획하고 있다.
이호 영업총괄 사장은 "씨젠만의 진단 기술력과 바이오라드의 장비 및 폭넓은 네트워크가 합쳐지면 미국 시장에서 우위를 차지하는 데 큰 도움이 될 것"이라며 "미국 진출은 향후 안정적인 매출 상승과 추가적인 해외 진출에도 큰 디딤돌이 될 것"이라고 말했다.
한민수 기자