'생명의 시계' 텔로미어, 미토콘드리아 분출 활성산소로 짧아져
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
미 피츠버그대 연구진, 미토콘드리아 연쇄반응 실험서 입증
미토콘드리아는 음식물의 영양분을 이용해 ATP라는 에너지원을 합성하는 세포 소기관이다.
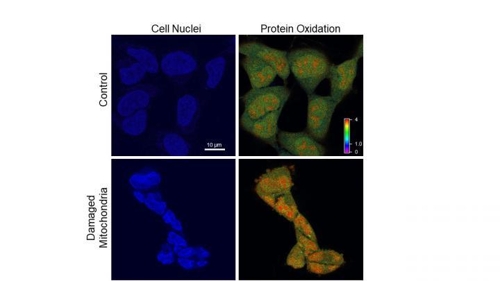
평소엔 생물체의 '에너지 공장' 역할을 하는 미토콘드리아지만, 이상이 생기면 완전히 다른 성질로 변해 세포 내 환경을 심각히 오염시킨다는 연구 결과가 나왔다.
요지는, 비정상인 미토콘드리아가 다량의 활성산소를 분출해 세포 전체를 오염시키고, 염색체 말단을 보호하는 텔로미어를 훼손하며, 결국 세포의 조기 노화를 유발한다는 것이다.
미토콘드리아에 문제가 생기면 이런 연쇄반응을 일으킬 수 있다는 건 오래된 학설이나, 구체적인 실험 증거로 입증된 건 처음이다.
미국 피츠버그대 의대(UPSM)의 베넷 반 하우턴 약물학·화학 생물학 교수팀은 이런 내용의 연구보고서를 최근 미국 국립과학원 회보(PNAS)에 발표했다.
27일 온라인(www.eurekalert.org)에 공개된 보도자료에 따르면 연구팀은, 미토콘드리아에 빛을 조사해 활성산소를 생성하게 하는 신기술을 적용했다.
이 기술은 카네기 멜런대 연구진이 개발한 것이다.
연구팀은 이렇게 활성산소를 내뿜는 미토콘드리아의 반응을, 과거 소련의 체르노빌 원자로 '멜트 다운(melt down)' 사고에 비유한다.
미토콘드리아의 활성산소 분출이 시작되면 중단할 수 없다는 점이 원자로의 핵 유출 사고와 비슷해 '체르노빌 효과'라고도 부른다.
하우턴 교수는 "빛을 차단하면 활성산소가 더 생기지 않지만, 이 과정에서 전자 전달 연쇄계(electron transport chain)가 교란된다"라면서 "그 결과 미토콘드리아는 48시간 후에도 계속해서 활성산소를 내뿜는다"고 말했다.
미토콘드리아가 내뿜는 활성산소의 공격에도 세포는 죽지 않았다.
하지만, 세포핵은 뒤틀려 쪼그라들고, 세포 분열은 중단됐다.
유전체 전체에선 DNA 손상도 관찰되지 않았다.
그러나 텔로미어는 언제라도 끊어질 것처럼 약해져 있었다.
염색체가 자동차라고 하면, 텔로미어는 번호판 크기에 불과하다.
그래서 연구팀은 텔로미어에 형광 태그를 달고 관찰한 끝에 겨우 텔로미어 손상을 확인했다.
텔로미어는 염색체 말단에 염기서열이 특이한 형태로 반복된 '종말체'인데, 염색체 손상이나 염색체 간의 이상 결합을 방지하는 기능을 한다.
세포가 분열할 때마다 텔로미어는 조금씩 짧아지며, 세포 분열이 일정한 횟수를 넘어서 텔로미어가 아주 짧아지면 해당 세포는 분열을 멈추고 죽는다.
그래서 텔로미어는 '생명의 시계'로 불리며 노화 억제의 열쇠로 주목받아 왔다.
그러나 미토콘드리아를 비활성화한 세포에 같은 실험을 한 결과, 활성산소 축적이나 텔로미어 손상은 전혀 관찰되지 않았다.
이는 이상이 생긴 미토콘드리아가 노화(텔로미어 손상)를 촉진할 수 있다는 걸 시사한다.
연구팀은 이번 실험에서, 유전자 손상의 복구에 관여하는 ATM(Ataxia telangiectasia mutated) 단백질을 억제하면, 미토콘드리아 분출 활성산소의 손상 효과가 극대화된다는 것도 알아냈다.
이럴 경우엔 세포도 오그라들어 죽었다.
이번 연구 결과가 광역학(photodynamic) 암 치료에 접목될 가능성이 높은 이유가 여기에 있다.
광역학 암 치료는, 광섬유 케이블을 통해 조사된 빛으로 활성산소를 생성해 고형암을 공격하는 것이다.
하우턴 교수는 "ATM을 억제하면서 기존의 광역학 치료법을 쓰면, 암세포 사멸 효과를 배가할 수 있을 것"이라고 강조했다.
/연합뉴스

평소엔 생물체의 '에너지 공장' 역할을 하는 미토콘드리아지만, 이상이 생기면 완전히 다른 성질로 변해 세포 내 환경을 심각히 오염시킨다는 연구 결과가 나왔다.
요지는, 비정상인 미토콘드리아가 다량의 활성산소를 분출해 세포 전체를 오염시키고, 염색체 말단을 보호하는 텔로미어를 훼손하며, 결국 세포의 조기 노화를 유발한다는 것이다.
미토콘드리아에 문제가 생기면 이런 연쇄반응을 일으킬 수 있다는 건 오래된 학설이나, 구체적인 실험 증거로 입증된 건 처음이다.
미국 피츠버그대 의대(UPSM)의 베넷 반 하우턴 약물학·화학 생물학 교수팀은 이런 내용의 연구보고서를 최근 미국 국립과학원 회보(PNAS)에 발표했다.
27일 온라인(www.eurekalert.org)에 공개된 보도자료에 따르면 연구팀은, 미토콘드리아에 빛을 조사해 활성산소를 생성하게 하는 신기술을 적용했다.
이 기술은 카네기 멜런대 연구진이 개발한 것이다.
연구팀은 이렇게 활성산소를 내뿜는 미토콘드리아의 반응을, 과거 소련의 체르노빌 원자로 '멜트 다운(melt down)' 사고에 비유한다.
미토콘드리아의 활성산소 분출이 시작되면 중단할 수 없다는 점이 원자로의 핵 유출 사고와 비슷해 '체르노빌 효과'라고도 부른다.
하우턴 교수는 "빛을 차단하면 활성산소가 더 생기지 않지만, 이 과정에서 전자 전달 연쇄계(electron transport chain)가 교란된다"라면서 "그 결과 미토콘드리아는 48시간 후에도 계속해서 활성산소를 내뿜는다"고 말했다.
미토콘드리아가 내뿜는 활성산소의 공격에도 세포는 죽지 않았다.
하지만, 세포핵은 뒤틀려 쪼그라들고, 세포 분열은 중단됐다.
유전체 전체에선 DNA 손상도 관찰되지 않았다.
그러나 텔로미어는 언제라도 끊어질 것처럼 약해져 있었다.
염색체가 자동차라고 하면, 텔로미어는 번호판 크기에 불과하다.
그래서 연구팀은 텔로미어에 형광 태그를 달고 관찰한 끝에 겨우 텔로미어 손상을 확인했다.
텔로미어는 염색체 말단에 염기서열이 특이한 형태로 반복된 '종말체'인데, 염색체 손상이나 염색체 간의 이상 결합을 방지하는 기능을 한다.
세포가 분열할 때마다 텔로미어는 조금씩 짧아지며, 세포 분열이 일정한 횟수를 넘어서 텔로미어가 아주 짧아지면 해당 세포는 분열을 멈추고 죽는다.
그래서 텔로미어는 '생명의 시계'로 불리며 노화 억제의 열쇠로 주목받아 왔다.
그러나 미토콘드리아를 비활성화한 세포에 같은 실험을 한 결과, 활성산소 축적이나 텔로미어 손상은 전혀 관찰되지 않았다.
이는 이상이 생긴 미토콘드리아가 노화(텔로미어 손상)를 촉진할 수 있다는 걸 시사한다.
연구팀은 이번 실험에서, 유전자 손상의 복구에 관여하는 ATM(Ataxia telangiectasia mutated) 단백질을 억제하면, 미토콘드리아 분출 활성산소의 손상 효과가 극대화된다는 것도 알아냈다.
이럴 경우엔 세포도 오그라들어 죽었다.
이번 연구 결과가 광역학(photodynamic) 암 치료에 접목될 가능성이 높은 이유가 여기에 있다.
광역학 암 치료는, 광섬유 케이블을 통해 조사된 빛으로 활성산소를 생성해 고형암을 공격하는 것이다.
하우턴 교수는 "ATM을 억제하면서 기존의 광역학 치료법을 쓰면, 암세포 사멸 효과를 배가할 수 있을 것"이라고 강조했다.
/연합뉴스




![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


