김선영 바이로메드 사장 "유전자치료제 상업생산 준비 단계 진입...기술수출 협상도 진행 중"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
통증성 당뇨병 유전자치료 신약 개발 중
FDA서 두 건의 글로벌 임상 3상 승인
2021년 신약 허가 목표
FDA서 두 건의 글로벌 임상 3상 승인
2021년 신약 허가 목표

김선영 바이로메드 연구개발 총괄사장(사진)은 유전자치료제 'VM202'에 대한 상업화 준비가 예정대로 순항하고 있다고 강조했다. 지난달 31일 서울대학교에 위치한 바이로메드 본사에서 만난 그는 2시간 넘게 진행된 인터뷰 내내 VM202란 단어가 나올 때마다 상기된 표정을 지어보였다.
현재 바이로메드의 임직원 수는 100명이 채 되지 않는다. 이 중 올해 채용한 인력만 30명에 가깝다. 지난 7월에는 미국 식품의약국(FDA)에서 11년 동안 신약의 임상 및 품목허가를 담당했던 박준태 박사를 부사장으로 영입했다.
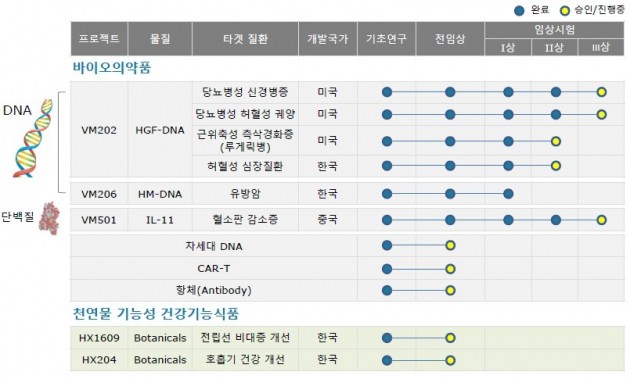
바이로메드는 미국에서 VM202에 대한 당뇨병성 신경병증과 당뇨병성 허혈성 궤양의 임상 3상, 근위축성 측삭경화증(루게릭병) 임상 2상을 진행 중이다. 박 박사는 기술이전 및 인허가 부문을 총괄한다. 바이로메드는 이를 위해 'LARA(Licensing and Regulatory Affairs)' 조직도 신설했다.
김 사장은 "최근 충원한 인력들은 모두 부장급 이상"이라며 "박 박사 외에도 제약업에 중요한 품질관리(QA·QC), 임상 총괄 의사, 생산공정 전문가 등 임상 및 생산 관련 부문을 강화했다"고 말했다.
VM202 원료 생산권을 가지고 있는 이연제약도 지난달 29일 충주공장 건설에 들어갔다. 이연제약 충주공장은 선진국 허가기준을 충족하는 수준으로 지어진다. 바이로메드의 유전자치료제 원료가 이곳에서 생산될 예정이다. 기술수출 및 상업생산을 위한 작업이 본격화되고 있는 것이다.
'VM202' 가치 높일 새로운 3상 승인
본격적인 상업생산 준비와 더불어 VM202의 가치를 높이는 시도도 이어지고 있다.
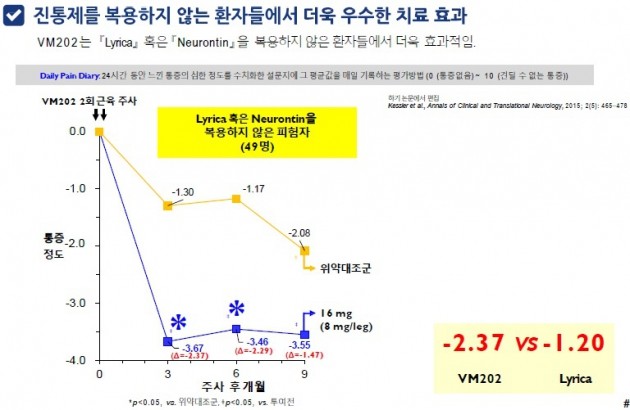
바이로메드는 지난 7월 FDA로부터 통증성 당뇨병성 신경병증(PDPN) 환자를 대상으로 하는 두번째 임상 3상을 승인받았다. 이번 임상은 PDPN 환자 중 진통제를 복용하지 않은 피험자 333명에게 VM202의 유효성 및 안전성을 평가할 계획이다.
PDPN은 당뇨병의 주요 합병증이다. 당뇨병으로 인한 신경세포 손상으로 비정상적인 신호전달이 일어나 극심한 통증을 느끼게 된다.
김 사장은 "PDPN 환자 중 기존 약물로 효과를 보지 못하는 사람들이 60~70%에 달한다"며 "첫번째 3상이 PDPN 환자 전체를 대상으로 했다면, 두번째 3상은 진통제를 복용하지 않은 환자만을 대상으로 해 VM202의 적용 대상을 PDPN 전체로 확대할 계획"이라고 말했다.
이번 3상을 통해 기존 약물이 듣지 않는 PDPN 환자 시장도 잡겠다는 것이다. PDPN 환자 30~40%에게 처방되는 의약품의 시장 규모는 3조~4조원으로 추산된다. 진통제가 듣지 않는 PDPN 환자까지 흡수하면 VM202의 PDPN 적용 시장은 대략 10조원으로 늘어나는 것이다.
그는 "두번째 3상을 진행하기로 한 것은 PDPN 2상에서 VM202가 기존 약물을 쓰지 않은 사람들에게서 더 좋은 효과를 보였기 때문"이라며 "두번째 3상도 첫번째와 비슷한 시기에 완료하는 것이 목표"라고 말했다.
임상 2상에서 진통제를 복용하지 않은 환자들의 통증 정도는, 복용한 사람들보다 약 2배 개선됐다.
VM202, 근본적 치료제 기대
바이로메드는 국내 최초 학내 벤처기업이다. 김 사장은 연구원 2명을 데리고 1996년 바이로메드를 창업했다. 국내 최초 유전자치료 임상시험 실시, 세계 최초 당뇨병성 신경병증 및 족부궤양 유전자치료 임상 3상 등 국내뿐 아니라 해외서도 유전자치료제 분야 선두 기업으로 꼽힌다.
미국과 유럽 등 선진국에서 허가받은 유전자치료제는 지난달 30일 FDA가 허가한 노바티스의 백혈병치료제 '킴리아'를 비롯해 모두 4개에 불과하다. 그만큼 차세대 기술이란 얘기다. 특히 유전물질인 DNA를 소재로 임상 3상에 들어가 있는 유전자치료제 3개 중 2개가 바이로메드의 것이다.
VM202는 유전자를 재조합해 두 종류의 간세포성장인자(HGF) 단백질을 대량 생산하도록 설계된 DNA 신약이다. 새로운 혈관 생성 및 손상된 신경을 재생하기 때문에 혈관이 막혀 생기는 질환의 근본적 치료제(disease modifying drug)가 될 것으로 기대되고 있다.
김 사장은 "올해 목표는 임상 순항과 기술이전 준비"라며 "기술이전의 경우 몇몇 글로벌 제약사들과 비밀유지 계약을 맺고 논의를 진행 중"이라고 말했다.
VM202 이후도 생각하고 있다. 그는 "VM202의 임상을 진행하는 동안 우수한 혈관 질환 및 통증 치료제가 개발됐다"며 "VM202 시판 이후 2025년께는 이 물질들이 글로벌 임상 3상 단계에 있을 것"이라고 했다.



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


