240억달러 시장서 치고나가는 삼성·셀트리온
후발주자 삼성의 '초스피드'
과감한 임상시험·집중 투자로 4년 만에 세계 최대 미국 시장 공략
개발기간 단축…2개 제품 상용화
바이오시밀러 시장 매년 급성장…셀트리온과 시장 선점 나서자
화이자·노바티스 등 제약사, 뒤늦게 바이오시밀러 경쟁 가세
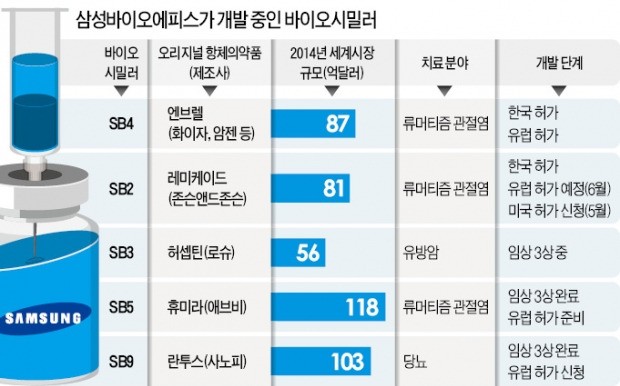
SB2는 연간 9조원어치가 팔리는 존슨앤드존슨의 항체의약품 ‘레미케이드’의 바이오시밀러다. 류머티즘 관절염, 궤양성 대장염, 강직성 척추염, 건선 등을 치료하는 바이오의약품이다. 삼성바이오에피스는 지난해 12월 국내에서 제품명 ‘렌플렉스’로 SB2의 판매 허가를 받았으며 오는 6월에는 유럽의약품청(EMA)의 최종 허가가 예정돼 있다.
◆글로벌 시장 겨냥한 ‘초스피드 R&D’
1호 바이오시밀러인 베네팔리를 제쳐두고 SB2의 미국 허가를 먼저 추진한 것은 특허를 피하기 위해서다. 레미케이드의 미국 특허 기간은 이미 끝나 바이오시밀러 판매가 가능하지만 엔브렐은 2028년까지 미국 특허가 남아 있어서다.
삼성바이오에피스는 SB2를 11개 국가에서 동시 임상시험을 하는 데 약 2000억원을 투입했다. 처음부터 미국 유럽 등 주요 시장을 겨냥해 글로벌 임상시험을 진행했다. 덕분에 유럽에 허가 신청한 임상자료를 미국 허가 신청 과정에서 활용할 수 있었다. 삼성바이오에피스는 유럽 판매 승인을 받은 2개 제품 외에 3개 바이오시밀러의 임상시험을 완료하고 허가를 추진하고 있다.
삼성이 개발 중인 5개 바이오시밀러의 오리지널 의약품 시장 규모는 2014년 기준 435억달러에 달했다. 회사 관계자는 “초기부터 과감한 글로벌 임상시험과 집중 투자를 통해 다른 바이오시밀러 개발사보다 개발기간과 허가기간을 크게 단축할 수 있었다”며 “5개에 달하는 다양한 바이오시밀러를 확보하고 있는 것도 큰 경쟁력”이라고 설명했다.
◆삼성·셀트리온, 시장 ‘쌍끌이’
삼성바이오에피스가 미국에 허가를 신청한 레미케이드 바이오시밀러는 셀트리온의 ‘램시마’와 성분이 같다. 램시마는 지난 4월 항체의약품 복제약 가운데 세계 최초로 미국 FDA의 판매 허가를 받았다. 오는 10월부터 화이자가 미국에서 본격적인 판매에 들어간다. 내년 하반기께 SB2가 출시되면 미국 시장에서 국내 바이오업체 제품끼리 경쟁하는 상황이 벌어지는 것이다. 미국 판매를 맡은 다국적 제약사 화이자(셀트리온)와 MSD(삼성바이오에피스)의 대리전도 관전 포인트다.
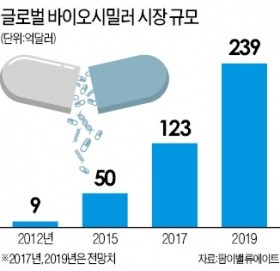
2012년 9억달러에 그친 세계 바이오시밀러 시장 규모는 연간 64.8%의 성장률을 보이며 2019년에는 239억달러 규모로 급증할 것으로 예상된다. 오리지널 의약품의 특허가 끝나면서 미국 유럽 등 주요 국가에서 가격은 싸면서 효과는 비슷한 바이오시밀러를 우대하는 정책을 펴고 있어서다.
업계 관계자는 “화이자 노바티스 등 글로벌 제약·바이오 기업들이 뒤늦게 바이오시밀러 개발 경쟁에 가세한 것도 이런 이유 때문”이라고 설명했다.
김형호 기자 chsan@hankyung.com
-
기사 스크랩
-
공유
-
프린트


![[포토] 에스앤아이코퍼레이션, 아주디자인그룹과 업무제휴 체결](https://img.hankyung.com/photo/202404/01.36468355.3.jpg)

![넷플릭스, 가입자 순증 꺾였다…악재 쏟아진 기술주 [글로벌마켓 A/S]](https://timg.hankyung.com/t/560x0/photo/202404/B20240419072033320.jpg)







![[신간] 휠체어를 탄 여성들…'우리의 활보는 사치가 아니야'](https://timg.hankyung.com/t/560x0/photo/202404/ZK.36468973.3.jpg)